В 2025 году журналу
ИСПОЛНИТСЯ
95 ЛЕТ!
ЧИТАЙТЕ
Материалы к юбилею >>>

РУБРИКИ
 Племенное дело |
 Крупный план |
 Актуально |
 Корма |
 Техническая политика |
 Событие |
 Ветеринария |
 Эксклюзивное интервью |
 Статистика |
 Выставки |
Творчество
наших читателей
ЧИТАЙТЕ
Автор С.И. КАЛИНИЧЕНКО
ГИМН СВИНЬЕ >>>
СТАТЬИ ИЗ НОМЕРА
DOI: 10.37925/0039-713X-2022-6-23-26
УДК 636.47
ОКСИДАТИВНЫЙ СТРЕСС И АПОПТОТИЧЕСКИЕ ПРОЦЕССЫ В КЛЕТКАХ ГРАНУЛЕЗЫ СВИНЕЙ ПРИ ВОЗДЕЙСТВИИ СВЕРХНИЗКИХ ТЕМПЕРАТУР
Т.И. КУЗЬМИНА, доктор биолог. наук, профессор, e-mail: prof.kouzmina@mail.ru, А.О. ПРИТУЖАЛОВА, младший научный сотрудник, е-mail: aklevakina14@mail.ru, лаборатория биологии развития, Всероссийский научно-исследовательский институт генетики и разведения сельскохозяйственных животных – филиал ФГБНУ «Федеральный научный центр животноводства ‒ ВИЖ имени академика Л.К. Эрнста» (Санкт-Петербург, г. Пушкин)
Охарактеризованы особенности функционирования нативных и девитрифицированных клеток гранулезы свиней при пролонгированном культивировании. Сверхнизкие температуры вызывают повышение уровня генерации активных форм кислорода и увеличение доли гранулезных клеток в состоянии апоптоза. Введение в состав криопротекторных и культуральных сред 0,001% наночастиц высокодисперсного кремнезема снижает уровень апоптотических клеток.
Ключевые слова: гранулеза, АФК, апоптоз, витрификация, культивирование, свинья.
Oxidative stress and apoptosis in porcine granulosa cells at effects of ultra-low temperatures
T.I. KUZMINA, doctor of biological sciences, professor, e-mail: prof.kouzmina@mail.ru, A.O. PRITUZHALOVA, junior researcher, е-mail: aklevakina14@mail.ru, developmental biology laboratory, Russian Research Institute of Farm Animal Genetics and Breeding ‒ Branch of the L.K. Ernst Federal Science Center for Animal Husbandry (St. Petersburg, Pushkin)
The features of the functioning of native and devitrified porcine granulosa cells at prolonged culture have characterized. Ultra-low temperatures cause an increase in the level of generation of reactive oxygen species and the proportion of apoptotic granulosa cells. The addition of 0.001% nanoparticles of highly dispersed silica in the composition of cryoprotective and culture media reduces the level of apoptotic cells.
Key words: granulosa, ROS, apoptosis, vitrification, culture, pig.
Введение
Успехи инновационных клеточных репродуктивных технологий, призванных интенсифицировать селекционно-генетические подходы в свиноводстве (конструирование и тиражирование новых генотипов), ветеринарии и биомедицине (ксенотрансплантация органов), в значительной степени зависят от эффективности начального этапа вышеуказанных биотехнологий – дозревания донорских ооцитов в различных средах для культивирования [1].
In vivo формирование зрелого ооцита проходит в тесном взаимодействии с клетками гранулезы (КГ) ‒ структурными компонентами овариального фолликула. Гранулезные клетки – продуценты стероидов и других биологически активных веществ, контролирующих завершение мейоза и приобретение компетентности к созреванию и оплодотворению яйцеклетки [2]. Кроме того, ядра клеток гранулезы используются в технологии клонирования животных [3].
Модификация сред для созревания ооцитов путем их кокультивирования с соматическими клетками антральных фолликулов приводит к улучшению показателей их фертильности [4]. Наличие у эмбриотехнологов криобанка гранулезных клеток с высокими качественными характеристиками значительно увеличит адекватность сред, применяемых для получения эмбрионов.
Результаты по культивированию клеток гранулезы зависят, в первую очередь от состава сред. Активные формы кислорода (АФК) являются производными кислорода ‒ молекулы, которые включают супероксидный анион (O2–), пероксид водорода (H2O2) и гидроксильный радикал (–OH). АФК в низких дозах являются важными сигнальными молекулами для поддержания метаболической активности клеток [5]. Однако чрезмерная генерация активных форм кислорода, которые накапливаются в клетках гранулезы из-за воздействия различных неблагоприятных факторов, вызывают оксидативный стресс и отрицательно влияют на показатели фертильности клеток. В свою очередь убедительно доказано, что оксидативный стресс индуцирует апоптоз в клетках гранулезы [6].
Известно также, что сверхнизкие температуры провоцируют деструктивные процессы в хроматине гранулезных клеток [7]. Следуя вышеизложенному, стоит отметить, что использование в составе культуральных сред реагентов, обладающих антиоксидантными свойствами, является перспективным для решения задачи снижения повреждающего действия криоконсервации на клетки гранулезы. Ранее в наших исследованиях выявлены положительные эффекты наночастиц высокодисперсного кремнезема на показатели жизнеспособности нативных соматических клеток овариальных фолликулов свиней (сокращение доли клеток с деструкцией хроматина, уровня апоптотических клеток) при культивировании [8].
Цель исследования ‒ идентифицировать особенности апоптотических процессов и генерации активных форм кислорода при пролонгированном культивировании девитрифицированных клеток гранулезы Sus scrofa domesticus и оценить характер влияния наночастиц высокодисперсного кремнезема на уровень апоптозов в гранулезных клетках, подвергшихся воздействию сверхнизких температур.
Материалы и методы исследований
В экспериментах использовали яичники свинок породы ландрас в возрасте шести-восьми месяцев на стадии фолликулярного роста без патологических изменений. Фолликулярную жидкость, содержащую клетки гранулезы, аспирировали из антральных фолликулов диаметром 3–6 мм с высоким тургором и обширной сетью капилляров, затем центрифугировали шесть минут при 300 об./мин. Осадок в виде суспензии клеток гранулезы дважды промывали в стерильном фосфатно-солевом буфере (PBS) и оценивали их жизнеспособность трипановым синим.
Для исследования использовали популяцию клеток с долей жизнеспособности не менее 50‒60%. Культивирование КГ проводили в ТС-199 с добавлением 10%-ной фетальной бычьей сыворотки (ФБС; Gibco, Thermo Scientific, USA), 10 мкг/мл гентамицина при температуре +38,5°C в атмосфере 5% СО2. Концентрация КГ составляла 106 клеток на 1 мл среды. Часть суспензии КГ обрабатывали тремя растворами криопротекторов (КПА), приготовленными на ТС-199: КПА-1 ‒ 0,7 M диметилсульфоксида (ДМСО) + 0,9 M этиленгликоля (ЭГ); КПА-2 ‒ 1,4 M ДМСО + 1,8 M ЭГ; КПА-3 ‒ 2,8 M ДМСО + 3,6 M ЭГ + 0,65 M трегалозы с экспонированием в течение трех минут в КПА-1, КПА-2 и пять минут ‒ в КПА-3. Перед каждой обработкой КПА КГ центрифугировали при 300 об./мин. в течение 60 секунд при комнатной температуре.
Криопробирки с КГ помещали в жидкий азот. Оттаивали образцы в водяной бане (+37°С) 120 секунд. Затем клетки поэтапно экспонировали в трех растворах с различными концентрациями трегалозы, приготовленными на основе ТС-199: в 0,25 М (три минуты), 0,19 М (три минуты) и далее в 0,125 М (три минуты). После каждого этапа клетки центрифугировали при 300 об./мин. 60 секунд при комнатной температуре.
Девитрифицированные КГ (концентрация ‒ 106 клеток на 1 мл среды) культивировали при +38,5°C в атмосфере 5% СО2 в течение 44 и 68 часов в ТС-199 + 10%-ной фетальной бычьей сыворотки + 10 мкг/мл гентамицина. Для определения доли клеток с повышенной генерацией АФК КГ дважды отмывали PBS (1200 об./мин. семь минут) и добавляли 2',7'-дихлорфлуоресцеин диацетат (DCFH-DA) в конечной концентрации 5 мкМ/мл с последующей инкубацией в течение 30 минут (+38,5°С). Затем клетки дважды отмывали от остатков флуорохрома (1200 об./мин. в течение семи минут) [9].
Содержание внутриклеточного радикала (H2O2) определяли методом проточной цитометрии с применением проточного цитометра CytoFLEX (Beckman Coulter Life Sciences, USA).
Определение доли мертвых клеток проводили после культивирования нативных и девитрифицированных клеток через 44 и 68 часов с помощью пропидия йодида (PI). КГ дважды отмывали в буфере PBS с осаждением при 1200 об./мин. в течение семи минут. Клетки анализировали сразу после добавления красителя PI к исследуемым образцам до конечной концентрации 5 мкг/мл, образцы оценивали ‒ на проточном цитометре CytoFLEX.
Во второй серии экспериментов в криопротекторные и культуральные среды добавляли нВДК (4‒17 нм, массовая концентрация ‒ 0,001%), синтезированные в ИХП имени А.А. Чуйко посредством высокотемпературного гидролиза. При выборе концентрации основывались на данных, представленных разработчиками [10].
Уровень апоптозов определяли методом TUNEL, для чего КГ помещали на покрытые poly-L-lysine предметные стекла, фиксировали в растворе формалина в течение 30 минут и промывали в PBS. Затем клетки выдерживали две минуты в 10%-ном растворе «Тритона Х-100» на 0,1%-ном цитрате натрия, повторно отмывали в PBS и инкубировали в темноте в течение 60 минут при +37°С с реактивом TUNEL (Kit from Boehringer Mannheim Cat.No. 1684795). После инкубации клетки промывали в растворе PBS и экспонировали в растворе PI (1 мг/мл). Вновь промывали в PBS, оставляли в темноте при комнатной температуре на один час, затем помещали в холодильник. Образцы анализировали на флуоресцентном микроскопе Carl Zeiss Axio Imager A2m.
Результаты обрабатывали с помощью статистической программы SigmaStat. Все использованные в исследовании реагенты, за исключением обозначенных, производства фирмы Sigma-Aldrich. Пластиковая лабораторная посуда фирмы BD Falcon™. Достоверность различия сравниваемых средних значений оценивали с помощью критерия х2 при трех уровнях значимости ‒ P<0,05, P<0,01, P<0,001.
Результаты исследований
В исследованиях использовали клетки гранулезы из 52 постмортальных яичников от 26 голов шести-восьмимесячных самок породы ландрас после убоя на мясоперерабатывающем комбинате «Тосненский» (Ленинградская обл.). В первой серии экспериментов оценивали показатели жизнеспособности и генерацию активных форм кислорода в нативных и девитрифицированных клетках гранулезы до и после пролонгированного культивирования. Обработка клеток гранулезы ультранизкими температурами (-196°С) обусловила резкое сокращение жизнеспособности клеток (рис. 1).
Рис. 1. Апоптотические процессы в нативных и девитрифицированных клетках гранулезы при пролонгированном культивировании
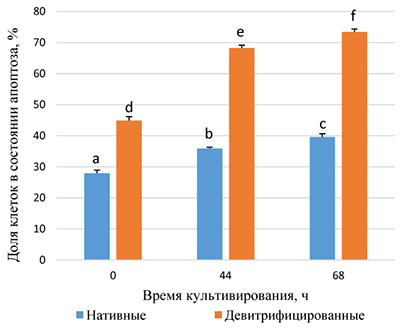
Примечание: a:d ‒ P˂0,05, a:e, a:f, b:e, b:f, c:e, c:f, d:e, d:f ‒ P˂0,01. N клеток – 6460 в трех повторностях.
Так, доля апоптотических нативных клеток до культивирования составила 28% против 45% девитрифицированных (Р<0,05). Не обнаружено достоверных различий в уровне жизнеспособных нативных клеток в динамике культивирования вплоть до 68 часов. Иная тенденция отмечена при анализе жизнеспособности клеток, подвергшихся процедуре витрификации (девитрификации). Уже через 44 часа культивирования выявлен достоверный рост доли нежизнеспособных клеток (68% против 45%; Р<0,01), а пролонгирование культивирования до 68 часов обусловило увеличение уровня мертвых клеток до 73%.
До и на всех этапах культивирования (44 и 68 часов) зафиксированы достоверные различия в уровне нежизнеспособных клеток между нативными и девитрифицированными клетками гранулезы.
Анализ показателей генерации внутриклеточного пероксида водорода выявил резкий подъем доли клеток, содержащих H2O2, в нативной гранулезе через 44 часа культивирования (97% против 43%; Р<0,01), через 68 часов этот параметр остался на прежнем уровне (95%), что соответствовало тенденции в оценке уровня апоптозов при пролонгированном культивировании гранулезы (рис. 2).
Рис. 2 Оксидативный стресс в нативных и девитрифицированных клетках гранулезы при пролонгированном культивировании
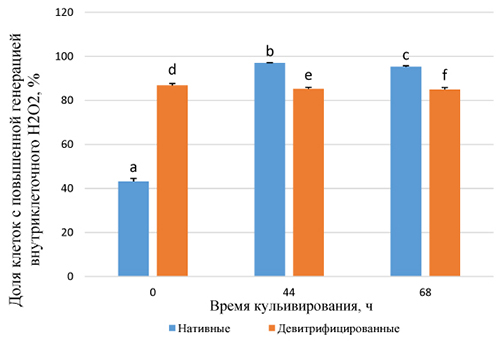
Примечание: c:d, c:e, c:f ‒ P˂0,05, a:b, a:c, a:d, a:e, a:f, b:d, b:e, b:f ‒ Р<0,01. N клеток – 8223 в трех повторностях.
Известно, что в случае дисфункции митохондрии индуцируются процессы, запускающие апоптоз [11]. Полученные нами данные могут свидетельствовать о том, что уже на начальном этапе культивирования клетки испытывают пагубное влияние оксидативного стресса. Сразу после девитрификации был зарегистрирован значительный рост доли клеток с высоким уровнем АФК по сравнению с показателями в группе нативных клеток (87% против 43%; Р<0,01) и их процентное содержание оставалось на том же уровне как через 44 часа (85%), так и через 68 часов (85%) культивирования.
В процессе криоконсервации на клетки оказывают влияние факторы, провоцирующие нарушения в работе антиоксидантной системы. Помимо оксидативного стресса в процессе витрификации (девитрификации) появляется высокий риск повреждения хроматина КГ вследствие кристаллизации [12]. Низкие показатели содержания АФК в исследуемой популяции девитрифицированных клеток гранулезы могут явиться результатом резкого сокращения количества жизнеспособных клеток как вследствие апоптоза, так и нарушения функциональной активности других клеточных компартментов.
Ранее в наших исследованиях по оценке уровня апоптоза в нативных и девитрифицированных клетках гранулезы Bos taurus выявлено снижение уровня апоптотических клеток при использовании в криопротекторных и культуральных средах наночастиц высокодисперсного кремнезема [13]. С учетом вышесказанного в следующей серии экспериментов нами исследовались апоптотические процессы в клетках гранулезы свиней при воздействии нВДК в условиях сверхнизких температур методом TUNEL (рис. 3).
Рис. 3. Влияние нВДК на апоптотические процессы в нативных и девитрифицированных клетках гранулезы при пролонгированном культивировании
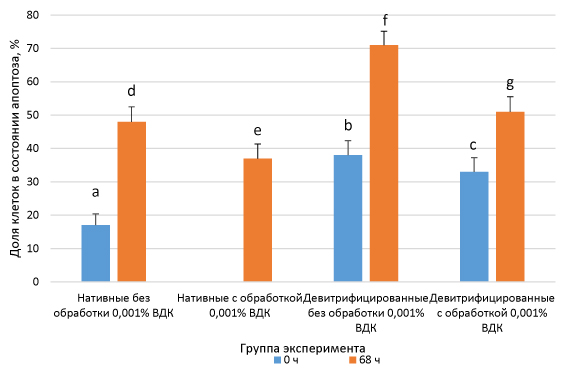
Примечание: c:d, e:g ‒ P˂0,05, a:b, a:c, a:d, a:e, a:f, a:g, b:f, c:f, c:g, d:f, e:f, f:g ‒ P˂0,01. N клеток – 7371 в трех повторностях.
Воздействие сверхнизких температур спровоцировало резкий рост доли клеток в состоянии апоптоза (17% против 38%; Р<0,001). При культивировании (68 часов) доля клеток с фрагментированной ДНК увеличилась как в группе нативных (17% против 48%; Р<0,01), так и в девитрифицированных клетках (38% против 71%; Р<0,001). Использование в составе криопротекторных сред 0,001% нВДК обеспечило резкое снижение уровня апоптотических клеток в группе девитрифицированной гранулезы после 68 часов культивирования (с 71% до 51%; Р<0,001).
В результате культивирования КГ с наночастицами 0,001% ВДК в популяции девитрифицированных клеток было выявлено достоверное снижение доли клеток с признаками апоптоза на 20% (P˂0,01). Возможные механизмы, вовлеченные в реализацию эффектов наночастиц на функционирование клетки, ряд авторов связывают с их полифункциональным действием, дозо- и размерозависимом влиянием на различные клеточные компартменты [14]. Rubio L. et al. (2019) отмечают неоднозначный характер воздействия наночастиц на разные типы клеток [15]. В настоящем исследовании впервые охарактеризованы эффекты нВДК на девитрифицированные клетки гранулезы из антральных овариальных фолликулов свиней до и после пролонгированного культивирования.
Заключение
Совершенствование существующих и разработка новых сред для криоконсервации биологического материала сельскохозяйственных животных – актуальная проблема крио- и эмбриотехнологов. В нашем исследовании охарактеризованы особенности воздействия ультранизких температур на соматические клетки овариальных фолликулов свиней при пролонгированном культивировании. Обнаружено, что витрификация провоцирует резкий подъем уровня генерации активных форм кислорода (оксидативный стресс) и усиление процессов апоптоза. Использование нВДК в составе криопротекторных и культуральных сред значительно снизило уровень апоптотических клеток в популяции, подвергшейся витрификации, что позволяет предложить их использование в качестве криозащитного агента при консервации клеток гранулезы свиней.
Работа поддержана Министерством науки и высшего образования Российской Федерации. Госзадание №0445-2021- 0005
Литература
- Chen P.R., Uh K., Redel B.K., Reese E.D., Prather R.S., Lee K. Production of pigs from porcine embryos generated in vitro. Frontiers in Animal Science, 2022. Vol. 3. Art. 826324. DOI: 10.3389/fanim.2022.826324.
- Uyar A., Torrealday S., Seli E. Cumulus and granulosa cell markers of oocyte and embryo quality. Fertility and Sterility, 2013. Vol. 99(4). P. 979–997. DOI: 10.1016/j.fertnstert.2013.01.129.
- Lee J.-W., Wu S.-C., Tian X.C., Barber M., Hoagland T., Riesen J., K. Lee H., Tu C.F., Cheng W.T.K., Yang X. Production of cloned pigs by whole-cell intracytoplasmic microinjection. Biology of Reproduction, 2003. Vol. 69. Iss. 3. P. 995–1001.
- Кузьмина Т.И. Моделирование систем созревания ооцитов свиней in vitro/Т.И. Кузьмина, Д.А. Новичкова, Н.А. Волкова. Сельскохозяйственная биология, 2013. №2. С. 52‒57. DOI: 10.15389/agrobiology.2013.2.52rus.
- Meng L., Wu Z., Zhao K., Tao J., Chit T., Zhang S., Wang C.C., Teerds K. Transcriptome analysis of porcine granulosa cells in healthy and atretic follicles: Role of steroidogenesis and oxidative stress. Antioxidants, 2021. Vol. 10(1). Art. 22. DOI: https://doi.org/10.3390/antiox10010022.
- Yang H., Xie Y., Yang D., Ren D. Oxidative stress-induced apoptosis in granulosa cells involves JNK, p53 and Puma. Oncotarget, 2017. Vol. 11:8(15). P. 25310‒25322. DOI: 10.18632/oncotarget.15813.
- 7. Kokotsaki M., Mairhoferc M., Schneeberger C., Marschaleka J., Pietrowskia D. Impact of vitrification on granulosa cell survival and gene expression. Cryobiology, 2018. 85. P. 73‒78.
- Кузьмина Т.И. Роль наночастиц высокодисперсного кремнезема в реализации эффектов гранулезы на компетентность к созреванию и оплодотворению ооцитов Sus scrofa domesticus/Т.И. Кузьмина, И.В. Чистякова, А.О. Притужалова, Д.Н. Татарская. Вавиловский журнал генетики и селекции, 2022. Т. 26. №3.
- Dikalov S., Harrison D. Methods for detection of mitochondrial and cellular reactive oxygen species. Antioxidants & Redox Signaling, 2014. 20(2). P. 372–382. DOI: 10.1089/ars.2012.4886.
- Galagan N.P., Klymenko N.Y., Orel I.L., Novikova E.A., Turov V.V. Biofunctional nanomaterials based on ultra-fine silica, protein and aminocarbohydrates. Biopolymers and Cell, 2010. 26(3). Р. 205‒213. DOI: 10.7124/bc.000158.
- Amoushahi M., Salehnia M. Reactive oxygen species level, mitochondrial transcription factor A gene expression and succinate dehydrogenase activity in metaphase II oocytes derived from in vitro cultured vitrified mouse ovaries. Veterinary Research Forum, 2018. №9(2). Р. 145–152. DOI: 10.30466/VRF.2018.30824.
- Бабийчук Л.А. Криоконсервирование ядросодержащих клеток кордовой крови под защитой непроникающего криопротектора ПЭО-1500/Л.А. Бабийчук, О.А. Михайлова, В.В. Рязанцев, П.М. Зубов, Р.К. Мигунова. Проблемы криобиологии и криомедицины, 2016. Т. 26(1). С. 24‒34.
- Кузьмина Т.И. Влияние наночастиц высокодисперсного кремнезема на апоптоз в нативных и девитрифицированных клетках гранулезы овариальных фолликулов Bos taurus/Т.И. Кузьмина, И.В. Чистякова. Актуальные вопросы ветеринарной биологии, 2019. №3(43). С. 8‒12. DOI:10.24411/2074-5036-2019-10031.
- Dong X., Wu Z., Li X., Xiao L., Yang M., Li Y., Duan J., Sun Z. The size-dependent cytotoxicity of amorphous silica nanoparticles: A systematic review of in vitro studies. International Journal of Nanomedicine, 2020. Vol. 15. P. 9089‒9113.
- Rubio L., Pyrgiotakis G., Beltran-Huarac J., Zhang Y., Gaurav J., Deloid G., Spyrogianni A., Sarosiek K., Bello D., Demokritou P. Safer-by-design flame-sprayed silicon dioxide nanoparticles: The role of silanol content on ROS generation, surface activity and cytotoxicity. Particle and Fibre Toxicology, 2019. Vol. 16. Art. 40. P. 1‒15.








