В 2025 году журналу
ИСПОЛНИТСЯ
95 ЛЕТ!
ЧИТАЙТЕ
Материалы к юбилею >>>

РУБРИКИ
 Племенное дело |
 Крупный план |
 Актуально |
 Корма |
 Техническая политика |
 Событие |
 Ветеринария |
 Эксклюзивное интервью |
 Статистика |
 Выставки |
Творчество
наших читателей
ЧИТАЙТЕ
Автор С.И. КАЛИНИЧЕНКО
ГИМН СВИНЬЕ >>>
СТАТЬИ ИЗ НОМЕРА
DOI: 10.37925/0039-713X-2025-4-25-28
УДК 636.4
КРАТКИЙ КУРС ЛЕЧЕНИЯ РЕСПИРАТОРНОГО СИМПТОМОКОМПЛЕКСА У СВИНЕЙ: РОЛЬ ФАРМАКОКИНЕТИКИ И ФАРМАКОДИНАМИКИ В СТРАТЕГИИ СДЕРЖИВАНИЯ АНТИБИОТИКОРЕЗИСТЕНТНОСТИ
М.Л. БЕРДНИКОВ, заместитель директора департамента продвижения ГК ВИК, e-mail: berdnikov@vicgroup.ru
Респираторные заболевания, вызываемые Actinobacillus pleuropneumoniae, Pasteurella multocida и Glaesserella parasuis, наносят значительный экономический ущерб свиноводству. В статье рассматривается стратегия применения короткого курса антибиотикотерапии на основе марбофлоксацина, соответствующего концепции SISAAB (Single Injection Short Acting AntiBiotic).
Ключевые слова: респираторный симптомокомплекс, марбофлоксацин, свиноводство.
Short course treatment of respiratory symptom complex in pigs: The role of pharmacokinetics and pharmacodynamics in the strategies to contain antibiotic resistance
M.L. BERDNIKOV, deputy director of promotion department, VIC Group, e-mail: berdnikov@vicgroup.ru
Respiratory diseases caused by Actinobacillus pleuropneumoniae, Pasteurella multocida, and Glaesserella parasuis lead to significant economic losses in pig farming. This article explores the strategy of short-course antibiotic therapy using marbofloxacin, aligned with the SISAAB (Single Injection Short Acting AntiBiotic) concept.
Key words: respiratory symptom complex, marbofloxacin, pig production.
Введение
Респираторный симптомокомплекс у свиней считается одной из наиболее значимых проблем в промышленном свиноводстве. Основными возбудителями системного респираторного заболевания являются Actinobacillus pleuropneumoniae, Pasteurella multocida и Glaesserella parasuis ‒ известные патогены из семейства Pasteurellaceae. Респираторный симптомокомплекс у животных широко распространен в странах с развитым свиноводством и наносит значительный экономический ущерб хозяйствам за счет высокой смертности поголовья и затрат на лечение больных животных, проведение ветеринарно-санитарных мероприятий.
Согласно статистике, более 75% АБП (антибактериальных препаратов) направлено на лечение респираторных инфекций, поэтому вопрос применения АБП при лечении инфекций с локализацией в легочной системе является одним из приоритетных в плане борьбы с распространением резистентности [9].
В связи с широким распространением лекарственной устойчивости микроорганизмов доступные АБП в ветеринарной практике становятся менее эффективными и затратными, а риски неблагоприятных исходов лечения животных растут. Это подчеркивает необходимость более глубокого изучения данной проблемы с учетом фармакокинетики и фармакодинамики антибиотика [1].
Заслуживает внимания такое действующее вещество, как марбофлоксацин, который бактерицидно влияет на основные возбудители респираторного тракта ‒ Actinobacillus pleuropneumoniae, Pasteurella multocida и Glaesserella parasuis с низким риском развития резистентности у патогенов. Он обладает высокой биодоступностью (более 90%), хорошим тканевым проникновением, особенно в ткани легких [12]. Создает высокие концентрации в лейкоцитах, что важно при лечении внутриклеточных инфекций, например Mycoplasma spp.
Марбофлоксацин ‒ это антибиотик из группы фторхинолонов III поколения, обладающий широким спектром антибактериальной активности. Фторхинолоны относятся к концентрационно-зависимым антибиотикам. Для них характерна корреляция между эффективностью и величиной отношения площади под фармакокинетической кривой (ПФК, или АUС) к минимальной подавляющей концентрации (МПК) [11]. Рост соотношения коррелирует с усилением терапевтического эффекта.
Механизм действия марбофлоксацина основан на ингибировании ключевых бактериальных ферментов ‒ ДНК-гиразы (топоизомеразы II) и топоизомеразы IV, которые участвуют в репликации, транскрипции и разделении дочерних хромосом. Связываясь с этими ферментами, марбофлоксацин нарушает суперспирализацию ДНК и вызывает накопление разрывов в двойной цепи, что приводит к остановке репликации и транскрипции.
Это вызывает необратимые повреждения генетического материала, активируя механизмы апоптоза или лизиса клетки и обеспечивая быстрый бактерицидный эффект [4]. Таким образом, даже после выведения антибиотика из схемы лечения бактерии не могут быстро восстановить свою ДНК, что продлевает их угнетение. То есть марбофлоксацин повышает чувствительность к фагоцитозу и после снижения концентрации антибиотика иммунная система продолжает уничтожать ослабленные бактерии.
Период полувыведения действующего вещества - марбофлоксацина длится до 14 часов. Например, у свиноматок период полувыведения составляет 8‒10 часов, а у молодых свиней ‒ 13 часов [10]. Это позволяет вводить препарат один раз в сутки. Данное фармакокинетическое свойство было использовано учеными еще в 2009 году, когда однократно применяли ударную дозу антибиотика – 10% марбофлоксацина.
Так была создана концепция лечения, основанная на однократном введении антибиотика короткого действия (SISAAB ‒ Single Injection Short Acting AntiBiotic). Она позволяет быстро достичь терапевтического эффекта при минимальном времени воздействия антибиотика на организм животного, способствуя активации естественного иммунитета после бактерицидного действия [2].
Концепция SISAAB строится на принципе концентрации, предотвращающей мутации (MPC ‒ mutant prevention concentration). Это минимальная концентрация антибиотика, которая подавляет рост самого устойчивого штамма бактерий и исключает возникновение резистентных мутантов. Методика предполагает использование дозы антибиотика, которая в четыре-восемь раз превышает концентрацию, необходимую для подавления 90% бактерий в популяции [3].
Экспериментальные данные K. Nedbalcova et al. (2018) подтверждают, что именно 10%-ная концентрация марбофлоксацина обеспечивает достижение начальной терапевтической концентрации, соответствующей ключевому требованию концепции SISAAB ‒ созданию достаточной ударной дозы для эффективного подавления бактериальной популяции при однократном введении [8].
Как видно из рисунка, однократное введение марбофлоксацина обеспечивает быстрый пик концентрации, значительно превышающей минимальную ингибирующую концентрацию (MIC), с последующим стремительным снижением до субтерапевтического уровня в течение 24 часов. Такой профиль существенно ограничивает временное окно, в котором концентрация антибиотика находится в диапазоне между MIC и концентрацией, предотвращающей мутации (MPC) ‒ период, наиболее опасный с точки зрения селекции резистентных штаммов.
В отличие от схем с многократным введением или использованием пролонгированных препаратов, при которых антибиотик длительно сохраняется в опасной зоне (между MIC и MPC), стратегия SISAAB минимизирует такой критический период. Это объясняет ее преимущество в снижении риска развития резистентности, так как время потенциального отбора мутантов первого порядка сокращается до минимально возможного.
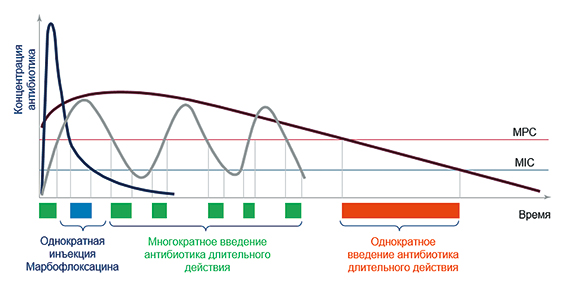
Рис. Сравнение времени преселекции мутаций при однократном введении марбофлоксацина (SISAAB) и многократном использовании пролонгированных антибиотиков [7]
Являясь липидорастворимой органической кислотой с умеренной связывающей способностью к белкам плазмы, марбофлоксацин демонстрирует глубокую степень проникновения в ткани и широкое распределение в организме. Особенно большие терапевтические концентрации антибиотика наблюдаются в легочной ткани, превышая его уровень в плазме крови [5, 6]. Результаты исследований подтверждают, что марбофлоксацин характеризуется благоприятными фармакокинетическими параметрами при парентеральном введении.
В Европе в период 2005–2013 годов в рамках исследования, посвященного мониторингу чувствительности респираторных патогенов к марбофлоксацину, было установлено, что уровень чувствительности к действующему веществу остается значительным [7]. Селекция устойчивости наблюдалась лишь у 0,4% изолятов Streptococcus suis, который также является ключевым агентом в развитии респираторного симптомокомплекса. Для других патогенов, таких как Actinobacillus pleuropneumoniae и Bordetella bronchiseptica, случаев селекции зарегистрировано не было. У Pasteurella multocida уровень селекции составил 0,1%, а у Glaesserella parasuis ‒ 1,4%.
Высокая эффективность марбофлоксацина в борьбе с респираторными патогенами, подтвержденная европейскими исследованиями, находит свое отражение и в ветеринарной практике РФ. Среди средств, содержащих марбофлоксацин и представленных на российском рынке, стоит отметить ветеринарный препарат «Марбофлоцин 10%», производимый компанией «АлексАнн» под брендом «Новая Группа».
Данный отечественный продукт изготавливается с использованием субстанции, соответствующей фармакопейным стандартам, с правильно подобранными эксципиентами, что обеспечивает 100%-ную стабильность препарата на протяжении всего срока годности, предотвращает деградацию действующего вещества и исключает токсичность.
Цель исследования – определение терапевтической эффективности «Марбофлоцина 10%» в сравнении с препаратом-аналогом.
Материалы и методы
Для подтверждения клинической эффективности ветеринарного препарата «Марбофлоцин 10%» на одном из промышленных свиноводческих предприятий Российской Федерации был проведен производственный опыт с определением терапевтической эффективности «Марбофлоцина 10%» в сравнении с препаратом-аналогом.
На предприятии у свиней в возрасте 120 дней с клиникой респираторного синдрома был лабораторно подтвержден диагноз «пневмония». Были выделены из легких павших животных и идентифицированы бактерии Actinobacillus pleuropneumoniae, Glaesserella parasuis и Streptococcus suis.
Далее из животных с клиническими симптомами было сформировано две группы ‒ контрольная (препарат-аналог) и опытная («Марбофлоцин 10%»). Свиньи были размещены в санитарных станках по 600 голов в каждом. Оба препарата применялись согласно инструкции и концепции терапии SISAAB однократно в дозировке 8 мг/кг по действующему веществу. Животные в контрольной и опытной группе (1200 голов) имели одинаковые условия содержания и кормления, возраст, вес.
Таблица. Результаты применения препарата «Марбофлоцин 10% при респираторном симптомокомплексе у свиней
|
Показатель |
«Марбофлоцин 10%» |
Препарат-аналог |
|
Кол-во животных, подвергшихся лечению, гол. |
600 |
600 |
|
Возраст, дн. |
120 |
120 |
|
Вес, кг |
90 |
90 |
|
Пало с патологическими признаками, характерными для респираторного симптомокомплекса, гол. |
3 |
10 |
|
Выбраковано, гол. |
4 |
15 |
|
Кол-во животных, подвергнутых повторному лечению, гол. |
15 |
50 |
|
Сохранность, % |
98,80 |
95,80 |
|
Стоимость сохраненных голов, руб. |
237 600,00 |
Как видно из таблицы 1, применение препарата «Марбофлоцин 10%» продемонстрировало более высокую эффективность: количество павших животных составило 3 против 10 голов в группе препарата-аналога, а число повторных обработок снизилось до 15 случаев по сравнению с 50. Сохранность животных в группе, в которой использовали «Марбофлоцин 10%», была 98,80%, что на 3% превышает показатель группы препарата-аналога (95,80%). Несмотря на более высокую стоимость обработки, применение «Марбофлоцин 10%» обеспечило экономическую выгоду за счет сохранения большего количества животных, что подтверждается расчетами стоимости сохраненных голов.
Выводы
Таким образом, препарат «Марбофлоцин 10%» в производственном опыте продемонстрировал не только высокую клиническую эффективность, но и экономическую целесообразность. Преимущество терапевтической эффективности «Марбофлоцина 10%» над аналогичным препаратом обусловлено постантибиотическим эффектом (ПАЭ), который играет ключевую роль в концепции терапии SISAAB.
Согласно исследованиям, длительность ПАЭ напрямую зависит от скорости достижения концентрации препарата, превышающей MIC90 целевого штамма не менее чем в четыре раза. При этом сбалансированный состав и хорошее качество вспомогательных компонентов обеспечивают «Марбофлоцину 10%» повышенную биодоступность и ускоренное всасывание в отличие от аналогичных препаратов [8]. Это способствует быстрому созданию терапевтических концентраций в очаге инфекции.
Постантибиотический эффект ‒ это период подавления роста бактерий, который сохраняется после кратковременного воздействия антимикробного препарата, даже когда его концентрация в организме становится неопределяемой.
Знание длительности ПАЭ имеет важное значение для клинической практики, так как позволяет оптимизировать режимы дозирования и повысить эффективность лечения инфекций бактериальной этиологии.
Длительный ПАЭ in vitro с высокой вероятностью указывает на благоприятный клинический исход, тогда как короткий ПАЭ может быть связан с неудовлетворительными результатами лечения. ПАЭ марбофлоксацина на Actinobacillus pleuropneumoniae, Pasteurella multocida и Glaesserella parasuis сохранялся в течение более долгого периода по сравнению с ампициллинами и прочими фторхинолонами [13].
Продолжительность постантибиотического эффекта является важным параметром, дополняющим фармакокинетический и фармакодинамический профиль антимикробных препаратов наряду с минимальной ингибирующей концентрацией.
Заключение
«Марбофлоцин 10%» является перспективным препаратом для лечения респираторного симптомокомплекса у свиней благодаря широкому спектру антибактериальной активности в отношении возбудителей, поражающих респираторную систему. Его применение обосновано оптимальными фармакокинетическими и фармакодинамическими характеристиками, включая высокую скорость всасывания, биодоступность, хорошее тканевое проникновение в легкие, бактерицидное действие, период полувыведения и выраженный постантибиотический эффект.
Указанные свойства в сочетании с рациональным подходом к лечению свиней респираторной патологии также способствуют снижению риска развития антимикробной резистентности.
В представленном производственном опыте препарат продемонстрировал высокий уровень терапевтической эффективности и безопасности, обеспечивая быстрое достижение клинического улучшения.
Таким образом, соблюдение научно обоснованных протоколов применения антимикробных средств ‒ ключевой фактор сохранения эффективности лечебных схем и устойчивого развития свиноводства.
Литература
- E. Hernandez-Cuellara, A.L. Guerrero-Barreraa, F.J. Avelar-Gonzalezb, J.M. Diazc, J. Chavez-Reyesd, A. Salazar de Santiago. Adhesion mechanisms of Actinobacillus pleuropneumoniae to the porcine respiratory system and biofilm formation. Austral. J. Vet. Sci., 2022. Vol. 54. №3. Valdivia set. https://www.sciencedirect.com/science/article/abs/pii/S0065291120300278.
- Hoeltig D., Rohde J., Brunner B., Hellmann K., Grandemange E. & Waldmann K.-H. Efficacy of a one-shot marbofloxacin treatment on acute pleuropneumonia after experimental aerosol inoculation of nursery pigs. Porcine Health Management, 2018. 4(1):1‒10. DOI: 10.1186/s40813-018-0089-2.
- Grandemange E., Perrin P.A., Cvejic D., Haas M., Rowan T. & Hellmann K. Randomised controlled field study to evaluate the efficacy and clinical safety of a single 8 mg/kg injectable dose of marbofloxacin compared with one or two doses of 7.5 mg/kg injectable enrofloxacin for the treatment of Actinobacillus pleuropneumoniae infections in growingfattening pigs in Europe. Porcine Health Management, 2017. 3(1):1‒12. DOI: 10.1186/S40813-017-0057-2/ FIGURES/1.
- Brown S.A. Fluoroquinolones in animal health. J. Vet. Pharm. Ther., 1996. 19:1.
- Lees P. & Shojaee Aliabadi F. Rational dosing of antimicrobial drugs: Animals versus humans. International Journal of Antimicrobial Agents, 2002. 19(4):269‒284. DOI: 10.1016/S0924-8579(02)00025-0.
- Dorey L., Pelligand L. & Lees P. Prediction of marbofloxacin dosage for the pig pneumonia pathogens Actinobacillus pleuropneumoniae and Pasteurella multocida by pharmacokinetic/pharmacodynamic modelling. BMC Veterinary Research, 2017. 13(1):1‒10. DOI: 10.1186/s12917-017-1128-y.
- El Garch F., Kroemer S., Galland D., Morrissey I. & Woehrle F. Survey of susceptibility to marbofloxacin in bacteria isolated from diseased pigs in Europe. Veterinary Record, 2017. 180(24):34‒60. DOI: 10.1136/vr.103954.
- Nedbalcova K., Zouharova M., Sperling D. Post-antibiotic effect of marbofloxacin, enrofloxacin and amoxicillin against selected respiratory pathogens of pigs. Veterinarni Medicina, 2019. Р. 64.
- Anon. EMEA/CVMP/627/01-Final Guideline for the demonstration of efficacy for veterinary medicinal products containing antimicrobial substances. 2001.
- MarbofloxacinIn subject area: Pharmacology, Toxicology and Pharmaceutical Science. https://www.sciencedirect.com/topics/pharmacology-toxicology-and-pharmaceutical-science/marbofloxacin.
- Ball P. Quinolone generations: Natural history or natural selection. J. Antimicrob. Chemother., 2000. 46(Suppl T1):17.
- Bryskier A. Fluoroquinolones/Bryskier A. (ed.)//Antimicrobial Agents: Antibacterials and Antifungals. Washington, DC: ASM Press, 2005. P. 668.
- Carbone M. et al. Activity and postantibiotic effect of marbofloxacin, enrofloxacin, difloxacin and ciprofloxacin against feline Bordetella bronchiseptica isolates. Vet. Microbiol., 2001. 81:79.