В 2025 году журналу
ИСПОЛНИТСЯ
95 ЛЕТ!
ЧИТАЙТЕ
Материалы к юбилею >>>

РУБРИКИ
 Племенное дело |
 Крупный план |
 Актуально |
 Корма |
 Техническая политика |
 Событие |
 Ветеринария |
 Эксклюзивное интервью |
 Статистика |
 Выставки |
Творчество
наших читателей
ЧИТАЙТЕ
Автор С.И. КАЛИНИЧЕНКО
ГИМН СВИНЬЕ >>>
СТАТЬИ ИЗ НОМЕРА
DOI: 10.37925/0039-713X-2022-8-33-37
УДК 636.47
ГОМЕОСТАЗ КАЛЬЦИЯ В ООЦИТАХ SUS SCROFA DOMESTICUS ПРИ КУЛЬТИВИРОВАНИИ IN VITRO
Т.И. КУЗЬМИНА, доктор биолог. наук, профессор, е-mail: prof.kouzmina@mail.ru, А.О. ПРИТУЖАЛОВА, мл. научный сотрудник, е-mail: aklevakina14@mail.ru, Д.Н. ТАТАРСКАЯ, аспирант, е-mail: dnk-21@mail.ru, Е.В. ПЕРНАК, биолог, е-mail: pernak.liza@mail.ru, лаборатория биологии развития, Всероссийский научно-исследовательский институт генетики и разведения сельскохозяйственных животных – филиал ФГБНУ «Федеральный исследовательский центр животноводства ‒ ВИЖ имени академика Л.К. Эрнста» (Санкт-Петербург, г. Пушкин)
Обосновано использование показателя уровня содержания мембраносвязанного кальция (интенсивность флуоресценции комплекса кальций + хлортетрациклин + мембрана) как биомаркера функционального состояния донорских ооцитов (растущие или завершившие фазу роста) в технологии экстракорпорального созревания женских гамет у домашней свиньи (Sus scrofa domesticus). Введение при созревании in vitro в состав культуральных сред наночастиц высокодисперсного кремнезема совместно с клетками гранулезы способствует мобилизации ионов кальция из внутриклеточных депо ооцитов, не завершивших фазу роста in vivo.
Ключевые слова: ооциты свиньи, ВСВ-тест, мембраносвязанный кальций, культивирование in vitro.
Сalcium homeostasis in Sus scrofa domesticus oocytes at in vitro culture
T.I. KUZMINA, doctor of biological sciences, professor, e-mail: prof.kouzmina@mail.ru, A.O. PRITUZHALOVA, junior researcher, е-mail: aklevakina14@mail.ru, D.N. TATARSKAYA, postgraduate, е-mail: dnk-21@mail.ru, E.V. PERNAK, biologist, е-mail: pernak.liza@mail.ru, developmental biology laboratory, Russian Research Institute of Farm Animal Genetics and Breeding ‒ Branch of the L.K. Ernst Federal Science Center for Animal Husbandry (St. Petersburg, Pushkin)
The use of the indicator of membrane-bound calcium content (fluorescence intensity of the complex calcium + chlortetracycline + membrane) as a biomarker of the functional state (growing or fully grown oocytes) of donor oocytes in the technology of extracorporeal maturation of female gametes Sus scrofa domesticus is substantiated. The addition of highly dispersed silica nanoparticles with granulosa cells to culture media at in vitro maturation promotes the mobilization of calcium ions from intracellular stores of oocytes that have not finished the growth phase in vivo.
Key words: porcine oocytes, BCB-test, membrane-bound calcium, in vitro culture.
Введение
Совершенствование и внедрение инновационных методов воспроизводства свиней, таких как трансгенез и клонирование, вызывает необходимость в наличии большого количества донорских ооцитов с положительными характеристиками. Несмотря на исследования, проводимые во многих лабораториях, технология производства эмбрионов свиней in vitro до сих пор не стандартизирована, выход зародышей на завершающей стадии доимплантационного развития составляет не более 50%, а качество эмбрионов, полученных in vivo, значительно превышает таковое in vitro [1].
Превентивная оценка компетентности женской гаметы к экстракорпоральному созреванию, оплодотворению и качество культуральных сред – важные составляющие технологии получения эмбрионов in vitro. ВСВ-диагностика исходной популяции ооцитов основана на использовании витального красителя бриллиантового кристаллического голубого в качестве биомаркера завершенности фазы роста женской гаметы in vivo. Одной из причин, не позволяющих повысить результативность основных показателей фертильности ооцитов, – гетерогенность популяции ооцитов по функциональному состоянию – растущие и завершившие фазу роста. Вышесказанное вызывает необходимость идентификации особенностей функционирования ооцитов, завершивших фазу роста in vivo или in vitro, в частности мониторинг показателей уровня содержания мембраносвязанного кальция в растущих или завершивших фазу роста женских гаметах
Изменения внутриклеточной концентрации кальция ‒ жизненно важный сигнальный механизм, обеспечивающий процессы роста, реинициацию мейоза, созревание ооцита, развитие эмбриона [2]. Кальций (Ca2+) является вторичным мессенджером, контролирующим Кальций (Ca2+) является вездесущим внутриклеточным сигналоммногочисленные клеточные процессы, аномалии в флуктуации его содержания могут привести к гибели клетки путем апоптоза или некроза.
Многочисленные исследования показали, что в цитоплазме во время созревания ооцитов перед оплодотворением происходит быстрое повышение уровня свободного цитоплазматического кальция [3, 4]. Оценка флуктуации содержания мембраносвязанного кальция, априори свидетельствующего о концентрации свободного интрацитоплазматического кальция, в динамике культивирования ооцитов в различном функциональном состоянии позволит оценить физиологичность процессов ядерно-цитоплазматического созревания в различных средах культивирования, в том числе и модернизированных путем введения в их состав соматических клеток овариальных фолликулов (клеток гранулезы) и наночастиц высокодисперсного кремнезема.
Цель исследования ‒ оценить флуктуацию содержания мембраносвязанного кальция в ооцитах Sus scrofa domesticus, завершивших фазу роста in vivo или in vitro, при их культивировании с соматическими клетками овариальных фолликулов и наночастицами высокодисперсного кремнезема.
Материалы и методы исследований
В экспериментах использовали донорские ооцит-кумулюсные комплексы, выделенные путем аспирации из овариальных фолликулов постмортальных яичников свинок породы ландрас (в возрасте шести-восьми месяцев) после их убоя на мясоперерабатывающем комбинате «Тосненский» (Ленинградская обл.).
Для исследований отбирали яичники на стадии фолликулярного роста без морфологических признаков патологий. После извлечения ооцит-кумулюсных комплексов (ОКК) из фолликулов с высоким тургором обширной васкуляризацией диаметром 3‒6 мм ооциты подвергали ВСВ-тесту. Для этого ооцит-кумулюсные комплексы отмывали три раза в растворе Дюльбекко с добавлением 0,4%-ного бычьего сывороточного альбумина. Затем ооцит-кумулюсные комплексы в течение 60 минут подвергали воздействию раствора 13 мкМ бриллиантового кристаллического голубого (BCB, B-5388), приготовленного на основе Дюльбекко. Выбор концентрации основывался на данных, полученных I. Egerszegi et al. (2010) [5]. По истечении времени инкубации с бриллиантовым кристаллическим голубым ооцит-кумулюсные комплексы отмывали в растворе Дюльбекко дважды и ранжировали под бинокулярной лупой в соответствии с окраской ооплазмы гаметы на ооциты ВСВ(+) (ооцит-кумулюсные комплексы с голубой окраской ооплазмы) и ооциты ВСВ(-) (ооцит-кумулюсные комплексы с неокрашенной ооплазмой).
Ооциты ВСВ(+) и ВСВ(-) культивировали раздельно в средах следующего состава:
первая группа (контроль) – синтетическая питательная среда North Carolina State University-23 (NCSU-23) + 10 МЕ хорионического гонадотропина человека + 10 МЕ хорионического гонадотропина лошади + 10% гомологичной фолликулярной жидкости (диаметр фолликулов ‒ 3–6 мм);
вторая группа – контроль + 0,001% нВДК;
третья группа – контроль + 1·106 клеток гранулезы (КГ) на 1 мл среды;
четвертая группа – контроль + 1·106 КГ на 1 мл среды + 0,001% нВДК (нВДК синтезированы в Институте прикладной химии имени А.А. Чуйко НАН Украины).
Отбор концентрации основывался на рекомендациях разработчиков [6]. Ооцит-кумулюсные комплексы культивировали 22 часа при температуре 38,5°C в атмосфере 5%-ного СО2 в вышеобозначенных средах, затем проводили смену сред с исключением во всех исследуемых группах гормональных добавок и последующим культивированием еще в течение 22 часов.
Для определения содержания депонированного Са2+ ооциты свиней очищали механическим способом с помощью препаровальной иглы от кумулюсных клеток. Инкубацию выделенных ооцитов проводили в течение пяти минут при 37°С в модифицированной инкубационной среде Дюльбекко, содержащей 36 мкг/мл пирувата Na, 1 мг/мл глюкозы, 40 мкМ хлортетрациклина, в отсутствие СаСl2. После этого нагруженные хлортетрациклином клетки три раза отмывали от инкубационной среды, содержащей хлортетрациклин, и переносили на специальное кварцевое стекло с ячейками объемом 0,05 мл. Зависимую от Са2+ флуоресценцию хлортетрациклина регистрировали в ооцитах в среде Дюльбекко. Интенсивность флуоресценции зонда хлортетрациклина в ооцитах измеряли флуориметрической установкой, состоящей из люминесцентного микроскопа, снабженного ртутной лампой постоянного тока ДРШ-250-3, необходимыми светофильтрами и фотометрической насадкой ФМЭЛ-1А. Спектр возбуждения комплекса хлортетрациклин ‒ Са2+ ‒ мембрана находился в области 380‒400 нм, максимум флуоресценции регистрировали в области 530 нм. Интенсивность флуоресценции комплекса хлортетрациклин ‒ Са2+ ‒ мембрана измеряли в условных единицах (усл. ед.). Длительность воздействия ультрафиолетового излучения на ооциты при проведении измерений не превышала пяти секунд.
Статус хроматина в ооцитах оценивали с использованием метода Тарковского [7, 8]. Ооцит-кумулюсные комплексы помещали на 5‒10 минут в 0,9%-ный раствор цитрата натрия и с помощью препаровальной иглы механически очищали от кумулюса. Далее клетки переносили на сухое обезжиренное стекло и фиксировали смесью метанола и уксусной кислоты (3:1). Высохшие препараты окрашивали по методу Гимза в модификации Романовского азур-эозином в течение 5‒10 минут в зависимости от качества красителя и промывали водой, а затем 70%-ном этанолом.
Для обработки результатов применяли статистическую программу SigmaStat. Все использованные в исследовании реагенты, за исключением обозначенных, производства фирмы Sigma-Aldrich. Пластиковая лабораторная посуда ‒ фирмы BD Falcon™. Достоверность различия сравниваемых средних значений оценивали с помощью t-критерий Стьюдента при трех уровнях значимости ‒ P<0,05, P<0,01, P<0,001.
Результаты исследований
До культивирования исследованию подвергались ооциты, окруженные компактным кумулюсом со слоями клеток не менее пяти-шести, гомогенной ооплазмой, равномерной по ширине зоной пеллюцида. После ранжирования женских гамет на основе ВСВ-теста в ооцитах, завершивших фазу роста in vivo [ВСВ(+)] и находящихся в фазе роста [ВСВ(-)], часть ооцитов подвергалась флуоресцентному анализу по определению уровня содержания кальция (мембраносвязанный кальций) во внутриклеточных депо (интенсивность флуоресценции комплекса кальций + хлортетрациклин + мембрана, выраженная в условных единицах).
Выявлены достоверные различия в уровне содержания мембраносвязанного кальция в ооцитах, завершивших фазу роста in vivo, и растущих гамет (рис. 1, 2). Так, интенсивность флуоресценции комплекса кальций + хлортетрациклин + мембрана в ВСВ(+)-ооцитах составила 0,70±0,014 усл. ед., а в ВСВ(-)-ооцитах ‒ 0,55±0,012 усл. ед. (Р<0,001). Данные по определению уровня содержания мембраносвязанного кальция в ооцитах, оцененных после ВСВ-теста как завершившие фазу роста, прокультивированных в течение 22 и 44 часов, представлены на рисунке 1.
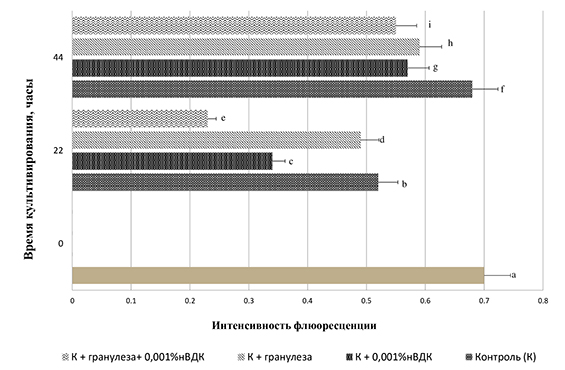
Рис. 1. Интенсивность флуоресценции комплекса хлортетрациклин ‒ мембрана ‒ Са2+ в завершивших фазу роста ооцитах Sus scrofa domesticus после культивирования в различных системах (n ооцитов ‒ 292)
a:b, a:c, a:d, a:e, a:g, a:i, b:c, b:e, b:f, c:d, c:f, c:g, c:h, c:i, d:e, d:f, e:f, e:g, e:h, e:i, f:g ‒ P˂0,001, a:h, d:g, f:i ‒ P˂0,01, c:e, d:h, f:h ‒ P ˂0,05.
Анализу подверглись 256 ооцитов. Через 22 часа в ооцитах всех исследуемых групп зафиксировано резкое снижение показателей интенсивности флуоресценции комплекса кальций + хлортетрациклин + мембрана. Минимальные показатели интенсивности флуоресценции комплекса кальций + хлортетрациклин + мембрана (0,23±0,04 усл. ед.; Р<0,001) выявлены в группе ооцитов, прокультивированных в средах, модернизированных совместным введением в их состав клеток гранулезы и 0,001% нВДК. Следует отметить, что эффект введения в среду культивирования нВДК как отдельно, так и совместно с клетками гранулезы выражался в достоверном снижении (Р<0,001) показателей уровня содержания мембраносвязанного кальция по сравнению с другими группами эксперимента. Через 44 часа культивирования интенсивность флуоресценции комплекса кальций + хлортетрациклин + мембрана значительно увеличилась во всех группах эксперимента.
Анализ показателей флуктуации содержания мембраносвязанного кальция в динамике культивирования 233 ооцитов, оцененных после их выделения из антральных фолликулов как растущие, представлены на рисунке 2.
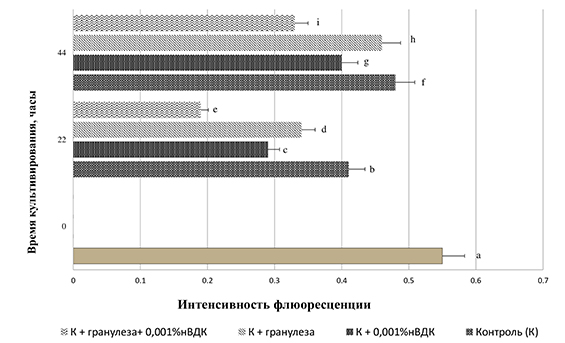
Рис. 2. Интенсивность флуоресценции комплекса хлортетрациклин ‒ мембрана ‒ Са2+ в ооцитах Sus scrofa domesticus, не завершивших фазу роста in vivo после культивирования в различных системах (n ооцитов ‒ 263)
a:b, a:c, a:d, a:e, a:g, a:h, a:i, b:c, b:e, c:e, c:f, c:g, c:h, d:e, d:h, e:f, e:g, e:h, e:i, f:i, h:i ‒ P˂0,001, g:i ‒ P˂0,05.
Во всех исследуемых группах отмечено достоверное снижение уровня содержания мембраносвязанного кальция после 22 часов культивирования по сравнению с базовым его содержанием в ВСВ(-)-ооцитах. Введение в состав культуральных сред нВДК значительно сокращало интенсивность флуоресценции комплекса кальций + хлортетрациклин + мембрана в гаметах. После пролонгирования времени культивирования до 44 часов показатели уровня содержания кальция серьезно возрастали независимо от состава сред для культивирования.
При сравнительном мониторинге флуктуации содержания мембраносвязанного кальция в ооцитах, оцененных на момент их выделения из фолликулов как растущие или завершившие фазу роста, обнаружилось, что через 22 часа культивирования в обеих анализируемых группах гамет отмечалось снижение показателей уровня содержания мембраносвязанного кальция независимо от системы созревания. Не выявлено достоверных различий между показателями интенсивности флуоресценции комплекса кальций + хлортетрациклин + мембрана в растущих и завершивших фазу роста ооцитах через 22 часа культивирования в условиях применения нВДК и нВДК совместно с клетками гранулезы (0,29±0,02 против 0,34±0,02 и 0,19±0,01 против 0,23±0,04 усл. ед.).
Значительные различия в уровне содержания кальция обнаружены между диагностированными как растущие и завершившие фазу роста ооцитами после 44 часов культивирования в зависимости от системы дозревания (контроль ‒ 0,48±0,04 против 0,68±0,02 (Р˂0,001), вторая группа ‒0,40±0,03 против 0,57±0,05 (Р˂0,001), третья группа – 0,46±0,02 против 0,59±0,04 (Р˂0,01), четвертая группа 0,33±0,01 против 0,55±0,04 (Р˂0,001).
Незрелые ооциты задерживаются в профазе первого мейотического деления, что морфологически идентифицируется как зародышевый пузырек. К этому моменту гамета должна завершить фазу роста, которая сопровождается осцилляцией кальциевого потока [9]. Реинициация мейоза знаменуется снятием блока и растворением (разрывом) зародышевого пузырька. Увеличение содержания цитозольного кальция играет ключевую роль в этом процессе. Хотя большое количество молекул вовлечено в сложные последовательности событий мейотического созревания, хорошо известно, что во время этого процесса кальций высвобождается из внутриклеточных депо [10].
В наших исследованиях на момент извлечения гамет из фолликулов обнаружен низкий уровень по сравнению с ВСВ(+)-ооцитами кальция в интрацеллюлярных депо незавершивших фазу роста in vivo ооцитах. Этот факт априори свидетельствует о высоком содержании цитоплазматического кальция в ооплазме, что в перспективе обеспечивает завершение фазы роста и реинициацию мейоза.
Рост показателей интенсивности флуоресценции комплекса кальций + хлортетрациклин + мембрана в растущих и завершивших фазу роста к 44 часам ‒ моменту, когда хроматин ядра достигает стадии метафазы II и наступает блок, вплоть до контакта яйцеклетки со сперматозоидом, видимо, свидетельствует о снижении роли процессов, детерминируемых осцилляцией кальциевых потоков [11].
Интерес к возможности применения наночастиц высокодисперсного кремнезема в репродуктивных технологиях основывается прежде всего на его антиоксидантных свойствах, способности выступать в качестве транспортировщика биологически активных молекул, в том числе и гормонов [12]. Использование в системах культивирования клеток гранулезы основывается на их функциональной активности (продукция стероидных гормонов и различных факторов роста). Ранее нами обнаружено позитивное влияние наночастиц высокодисперсного кремнезема на показатели фертильности донорских ооцитов коров и свиней. Эффекты были более выражены в присутствии клеток гранулезы [13, 14]. Выявленные особенности кальциевого гомеостаза в ооцитах с различным функциональным состоянием в условиях культивирования с наночастицами высокодисперсного кремнезема, свидетельствующие об интенсификации высвобождения кальция из внутриклеточных депо, вероятно, обеспечивают возможность завершения ВСВ(-)-ооцитами фазы роста in vitro и реинициации мейоза.
Заключение
В настоящем исследовании охарактеризован гомеостаз кальция в донорских ооцитах свиней, различных по функциональному состоянию (растущие или завершившие фазу роста) до и при экстраовариальном культивировании. При проведении экспериментов обнаружено, что введение в состав культуральных сред наночастиц высокодисперсного кремнезема совместно с клетками гранулезы обеспечивает высокий уровень мобилизации кальция из внутриклеточных депо. В результате сравнительного мониторинга показателей уровня содержания мембраносвязанного кальция в ооплазме гамет установлены различия между уровнем содержания мембраносвязанного кальция в растущих и завершивших фазу роста ооцитах. Вышеизложенное позволяет рассматривать показатель интенсивности флуоресценции мембраносвязанного кальция в донорском ооците в качестве биомаркера функционального статуса гаметы и в соответствии с полученным при оценке исходной популяции ооцитов результатом моделировать состав сред и временные параметры экстракорпорального культивирования женских гамет Sus scrofa domesticus.
Работа поддержана Российским фондом фундаментальных исследований, проект №22-16-00084
Литература
- Chen P.R., Redel B.K., Kerns K.C., Spate L.D., Prather R.S. Challenges and considerations during in vitro production of porcine embryos. Cells, 2021. Vol. 10. Art. 2770. DOI: 10.3390/cells10102770.
- Wakai T., Mehregan A. & Fissore R.A. Ca2+ signaling and homeostasis in mammalian oocytes and eggs. Cold Spring Harbor Perspectives in Biology, 2019. Vol. 11(12). Art. 035162. DOI: 10.1101/cshperspect.a035162.
- Sanders J.R., Jones K.T. Regulation of the meiotic divisions of mammalian oocytes and eggs. Biochemical Society Transactions, 2018. Vol. 46. Р. 797–806. DOI: 10.1042/BST20170493.
- Cheon B., Lee H.C., Wakai T., Fissore R.A. Ca2+ influx and the store operated Ca2+ entry pathway undergo regulation during mouse oocyte maturation. Molecular Biology of the Cell, 2013. Vol. 24. Р. 1396–1410. DOI: 10.1091/mbc.E13-01-0065.
- Egerszegi I., Alm H., Rátky J., Heleil B., Brüssow K.P., Torner H. Meiotic progression, mitochondrial features and fertilization characteristics of porcine oocytes with different G6PDH activities. Reproduction, Fertility and Development, 2010. Vol. 22(5). Р. 830‒838. DOI: 10.1071/RD09140.
- Зюзюн А.Б., Щербак О.В., Осипчук О.С., Ковтун С.І., Дзіцюк В.В. Застосування наноматеріалу в ембріогенетичній системі in vitro отримання ембріонів свиней. Фактори експериментальної еволюції організмів, 2015. Т. С. 164‒168.
- Tarkowski A. An air drying method for chromosomal preparation from mouse eggs. Cytogenetic, 1966. Vol. 1. Р. 394‒400.
- Кузьмина Т.И. Методы получения эмбрионов свиней in vitro/Кузьмина Т.И., Альм Х., Торнер Х. СПб, 2008. 38 с.
- Tosti E. Calcium ion currents mediating oocyte maturation events. Reproductive Biology and Endocrinology, 2006. Vol. 4. Art. 26. DOI: 10.1186/1477-7827-4-26.
- Tosti E., Boni R., Gallo A., Silvestre F. Ion currents modulating oocyte maturation in animals. Systems Biology in Reproductive Medicine, 2013. Vol. 59(2) Р. 61‒68. DOI: 10.3109/19396368.2012.758790.
- Fazeli E., Hosseini A., Heidari M.H., Farifteh-Nobijari F., Salehi M., Abbaszadeh H.A., Nazarian H., Shams Mofarahe Z., Ayoubi S., Hosseini S., Shayeghpour M., Bandehpour M., Ghaffari N.M. Meiosis resumption of immature human oocytes following treatment with calcium ionophore in vitro. Cell journal, 2021. Vol. 23(1). Р. 109‒118. DOI: 10.22074/cellj.2021.7130.
- Silva J.R.V., Barroso P.A.A., Nascimento D.R., Figueira C.S., Azevedo V.A.N., Silva B.R., Santos R.P.D. Benefits and challenges of nanomaterials in assisted reproductive technologies. Molecular Reproduction and Development, 2021. Vol. 88. P. 707–717. DOI: 10.1002/mrd.23536SILVAET AL.
- Кузьмина Т.И., Татарская Д.Н. Влияние наночастиц высокодисперсного кремнезема на показатели фертильности ооцитов Bos taurus, завершивших фазу роста in vivo или in vitro. Молочное и мясное скотоводство, 2022. №4. С. 53‒56. DOI: 10.33943/MMS.2022.74.90.009.
- Кузьмина Т.И., Чистякова И.В., Притужалова А.О., Татарская Д.Н. Роль наночастиц высокодисперсного кремнезема в реализации эффектов гранулезы на компетентность к созреванию и оплодотворению ооцитов Sus scrofa domesticus. Вавиловский журнал генетики и селекции, 2022. №26(3). С. 234‒239. DOI: 10.18699/VJGB-22-30.








