В 2025 году журналу
ИСПОЛНИТСЯ
95 ЛЕТ!
ЧИТАЙТЕ
Материалы к юбилею >>>

РУБРИКИ
 Племенное дело |
 Крупный план |
 Актуально |
 Корма |
 Техническая политика |
 Событие |
 Ветеринария |
 Эксклюзивное интервью |
 Статистика |
 Выставки |
Творчество
наших читателей
ЧИТАЙТЕ
Автор С.И. КАЛИНИЧЕНКО
ГИМН СВИНЬЕ >>>
СТАТЬИ ИЗ НОМЕРА
DOI: 10.37925/0039-713X-2023-1-56-59
УДК 636.4.087.7
МИКРОБИОМ КИШЕЧНИКА ПОРОСЯТ В ПЕРИОД ДОРАЩИВАНИЯ ПРИ ИСПОЛЬЗОВАНИИ ПРОБИОТИКА «ЛИКВАФИД»
А.В. ФИЛАТОВ, доктор вет. наук, профессор, А.В. ЯКИМОВ, аспирант, ФГБОУ ВО «Вятский государственный агротехнологический университет», А.И. БАХТЕЕВА, ветеринарный врач, ветеринарная клиника «Ника» (Санкт-Петербург)
В статье представлены итоги исследования влияния пробиотика «ЛикваФид» на микробиом ободочного отдела кишечника свиней в период доращивания. При использовании метода ПЦР в реальном времени установлено, что рассматриваемый пробиотический комплекс способствовал повышению общего числа бактерий в содержимом ободочного отдела кишечника группы контрольных поросят. У опытных поросят отмечалось увеличение доли в бактериальном сообществе представителей нормофлоры. В структуре нормофлоры ободочного отела кишечника у опытных животных происходил количественный рост представителей родов Prevotella spp., Porphyromonas spp., Eubacterium spp., Lachnobacterium spp., Clostridium spp., Megasphaera spp., Veillonella spp., Dialister sрp. и Lactobacillus spp. На фоне роста представителей нормофлоры наблюдалось снижение условно-патогенных и патогенных микроорганизмов.
Ключевые слова: пробиотик, «ЛикваФид», свиньи, доращивание, ПЦР, микробиом, ободочная кишка.
Intestinal microbiota of piglets during the growing period using the probiotic LiquaFid
А.V. FILATOV, doctor of veterinary sciences, professor, A.V. YAKIMOV, post-graduate student, Vyatka State Agrotechnological University, A.I. BAKHTEEVA, veterinarian, veterinary clinic Nika (St. Petersburg)
The article presents the results of a study of the effect of the LiquaFid probiotic on the colonic microbiome of pigs during the growing period. When using the real-time PCR method, it was found that the probiotic complex contributed to an increase in the total number of bacteria in the contents of the colon of the intestine relative to the group of control pigs. In experimental piglets, an increase in the proportion of normoflora representatives in the bacterial community is noted. In the structure of the normoflora of the colon calving in experimental animals, there is a quantitative increase in representatives of the genera Prevotella spp., Porphyromonas spp., Eubacterium spp., Lachnobacterium spp., Clostridium spp., Megasphaera spp., Veillonella spp., Dialister spp. and Lactobacillus spp. Against the background of the growth of representatives of the normoflora, a decrease in opportunistic and pathogenic microorganisms is observed.
Key words: probiotic, LiquaFid, pigs, rearing, PCR, microbiome, colon.
Введение
Желудочно-кишечный тракт свиней обильно населяют различные микроорганизмы. В просвете кишечника наиболее часто встречаются филумы Firmicutes и Bacteroidota, за которыми следуют Fusobacteriota, Proteobacteria, Actinobacteriota и Spirochaetota [2‒4]. Таксономический профиль различается в зависимости от отдела кишечника. Для филумов Bacteroidota и Firmicutes установлены статистически значимые различия между отделами кишечника, которые характеризуются общим уменьшением Firmicutes и одновременным увеличением Bacteroidota по направлению от подвздошной к прямой кишке, что коррелирует с их различными метаболическими функциями [2].
Кишечный микробиом свиньи имеет существенное значение для ее хозяина, выполняя различные функции ‒ переваривание питательных веществ, формирование устойчивости к болезням, производство витаминов и полезных метаболитов, что дает обоснованный повод полагать, что микробиом также непосредственно влияет на рост и эффективность использования животными корма [5]. Следовательно, изучение микробиома и его корректировка для достижения наиболее лучших продуктивных показателей у животных имеет большие перспективы.
Цель работы ‒ проведение оценки микробиоценоза содержимого ободочной кишки поросят по завершении периода доращивания, получавших пробиотический препарат «ЛикваФид» с питьевой водой через систему поения.
Материалы и методы исследования
Для проведения исследования поросят после отъема в возрасте 28 дней разделили по принципу аналогов на две группы ‒ опытную и контрольную. Свиньям опытной группы с питьевой водой ежедневно в течение 56 дней периода содержания на доращивании выпаивали пробиотический комплекс «ЛикваФид» в количестве 50 г на 1 т воды. Животные контрольной группы получали питьевую воду без добавления пробиотика. Далее производили убой контрольных и опытных поросят по три головы из каждой группы. Непосредственно после убоя осуществляли отбор содержимого ободочного отдела кишечника свиней с соблюдением правил асептики. Биоматериал весом 3‒4 г помещали в стерильные пластиковые пробирки Эппендорфа. Транспортировка материала совершалась в термоконтейнере с охлаждающими элементами. Хранение биопроб до лабораторных исследований выполнялось при температуре -20ºС.
Лабораторные исследования содержимого ободочной кишки осуществляли с применением молекулярно-биологических анализов в молекулярно-генетической лаборатории компании «БИОТРОФ».
Извлечение тотальной ДНК происходило с применением набора Genomic DNA Purification Kit (Thermo Fisher Scientific, США), задачей которого является экстракция ДНК из обширного числа источников.
Анализ работы флуориметра Qubit в совокупности с набором реагентов Qubit dsDNA BR Assay Kit (Thermo Fisher Scientific, Литва) показал результаты в количественном эквиваленте ДНК не менее 50 ng/μl.
Для проведения ПЦР в реальном времени были задействованы специальный прибор ‒ амплификатор «ДТлайт 4» (ООО «НПО ДНК-Технология», Россия) и необходимые наборы реактивов разнопланового спектра применения для его работы. Принцип работы амплификатора заключается в повторяющихся циклах: температурной денатурации ДНК, отжиге праймеров с комплементарными последовательностями и последующей достройкой полинуклеотидных цепей с этих праймеров термостабильной ДНК-полимеразой.
Для проведения реакции на амплификаторе использовались реактивы, входящие в набор для ПЦР-РВ, с наличием в составе красителя Eva Green (ЗАО «Синтол», Россия) и необходимые для этого соответствующие праймеры (5'‒3'). Сами условия проведения амплификации предопределены применяемыми праймерами и соответствовали их оптимальным требованиям во всех циклах работы амплификатора. Наилучшими условиями работы праймеров в данном случае были: 95°С ‒ 3 минуты (первый цикл), 95°С ‒ 13 секунд, 57°С ‒ 13 секунд, 72°С ‒ 30 секунд (40 циклов).
Также набор содержит внутренний контрольный образец, предназначенный для оценки эффективности протекания ПЦР-реакции. Для повышения чувствительности и специфичности реакции предусмотрено применение горячего старта, который обеспечивается особым составом реакционной смеси, включающей два слоя, разделенных прослойкой из парафина. Смешение слоев и превращение их в амплификационную смесь происходит только после плавления парафина, что исключает неспецифический отжиг праймеров на ДНК-мишени при начальном прогреве пробирки. В реакционную смесь для проведения ПЦР введены ДНК-зонды, каждый из которых несет флуоресцентную метку и гаситель флуоресценции. При образовании специфичного продукта ДНК-зонд разрушается, действие гасителя на флуоресцентную метку прекращается, что ведет к возрастанию уровня флуоресценции.
Количество разрушенных зондов возрастает пропорционально количеству образовавшихся специфических ампликонов и измеряется на каждом цикле амплификации. В состав ДНК-зондов, использующихся для детекции продуктов амплификации фрагментов геномов определяемых микроогранизмов, включена флуоресцентная метка Fam.
После прохождения ПЦР-амплификации в реальном времени на основании стандартов с известной концентрацией геномов программно рассчитывали общее количество всех бактерий, а также число микроорганизмов, входящих в отдельные группы.
Результаты исследования
При использовании молекулярно-генетических подходов выявили, что общая бактериальная масса и качественные показатели содержимого ободочной кишки свиней по завершении периода доращивания существенно различаются между группами (табл.).
На фоне применения поросятам пробиотического комплекса «ЛикваФид» общее число бактерий в содержимом кишечника составило 9,24 х 107 ± 3,47 х 107 lg геномов/г, что в 3,12 раза больше, чем в контроле. Количественное увеличение разнообразия микробиоты в просвете ободочной кишки при использовании пробиотического средства лимитируется благоприятными условиями для ее роста и развития, среди которых оптимальный уровень рН-среды и наличие питательных субстратов.
Таблица. Сравнительное количество микроорганизмов в содержимом ободочной кишки свиней (lg геномов/г)
|
Микроорганизм |
Группа |
|
|
опытная |
контрольная |
|
|
Общее кол-во бактерий |
9,24 х 107 ± 3,47 х 107 |
2,96 х 107 ± 2,50 х 107 |
|
Нормофлора |
||
|
Prevotella spp., Porphyromonas spp. |
15,28 х 106 ± 8,17 х 106 |
3,96 х 106 ± 1,81 х 106 |
|
Eubacterium spp. |
7,37 х106 ± 4,21 х 106 |
1,94 х 106 ± 0,68 х 106 |
|
Lachnobacterium spp., Clostridium spp. |
4,42 х 107 ± 2,80 х 107 |
1,01 х 107 ± 0,75 х 107 |
|
Lactobacillus spp. |
2,05 х 107 ± 0,62 х 107 |
0,85 х 107 ± 0,83 х 107 |
|
Megasphaera spp., Veillonella spp., Dialister sрp. |
10,15 х 105 ± 5,17 х 105 |
2,37 х 105 ± 0,97 х 105 |
|
Нежелательная микрофлора |
||
|
Peptostreptococcus spp. |
15,28 х 105 ± 8,17 х 105 |
17,68 х 105 ± 1,90 х 105 |
|
Enterobacteriaceae spp. |
4,15 х 105 ± 1,90 х 105 |
6,42 х 105 ± 1,43 х 105 |
|
Mobiluncus spp., Corynebacterium spp. |
0,92 х 104 ± 0,35 х 104 |
1,00 х 104 ± 0,29 х 104 |
|
Atopobium spp. |
5,28 х 101 ± 1,91 х 101 |
5,28 х 101 ± 1,91 х 101 |
|
Патогены |
||
|
Fusobacterium spp., Sneathia spp., Leptotrichia spp. |
0,33 х 103 ± 0,33 х 103 |
2,10 х 103 ± 2,10 х 103 |
|
Streptococcus spp. |
2,42 х 106 ± 3,40 х 106 |
2,44 х 106 ± 1,37 х 106 |
|
Staphylococcus spp. |
4,91 х 103 ± 2,58 х 103 |
3,34 х 103 ± 0,83 х 103 |
|
Mycoplasma spp. |
<п.д.о.* |
<п.д.о.* |
|
Ureaplasma spp. |
<п.д.о.* |
<п.д.о.* |
|
Candida spp. |
10,17 х 104 ± 5,63 х 104 |
0,54 х 104 ± 0,04 х 104 |
* ‒ предел достоверного определения методом количественной ПЦР.
В просвете содержимого ободочной кишки в обеих группах выявили представителей нормофлоры, нежелательных и патогенных микроорганизмов. Необходимо отметить, что у всех животных полезные микроорганизмы превалировали в количественном составе, что свидетельствовало об их здоровом состоянии. Вместе с тем структура различных микробных популяций и общего числа бактерий в подопытных группах существенно различалась. На фоне применения пробиотического комплекса происходило увеличение доли в бактериальном сообществе представителей нормофлоры на 12,05% при снижении условно-патогенных и патогенных микроорганизмов на 6,05% и 5,54% соответственно по сравнению с контролем (рис.).
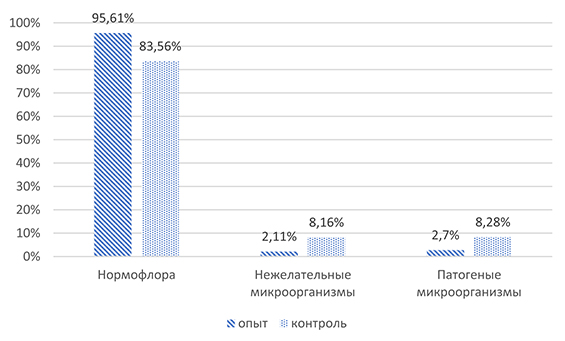
Рис. Структура микробных популяций от общего количества бактерий в содержимом ободочной кишки
В структуре нормофлоры у подопытного молодняка свиней самыми многочисленными микроорганизмами были популяции клостридий родов Lachnobacterium spp., Clostridium spp., лактобацилл рода Lactobacillus spp. и бактероиды родов Prevotella spp. и Porphyromonas spp., а наименьшими ‒ эубактерии рода Eubacterium spp. и лактат-утилизирующие бактерии родов Megasphaera spp., Veillonella spp., Dialister sрp.
По количественному росту в ободочной кишке доминантную позицию занимали представители родов Lachnobacterium spp., Clostridium spp. Их численность в опытной группе составила 4,42 х 107 ± 2,80 х 107 lg геномов/г, что в 4,4 раза больше, чем в группе контрольных животных. Данные представители микроорганизмов обладают ферментами для расщепления крахмалистых полисахаридов, что может указывать на более полный метаболизм легкогидролизуемых компонентов кормов у опытных животных.
Представителей нормофлоры рода Prevotella spp., Porphyromonas spp. и Eubacterium spp. в просвете ободочной кишки на фоне применения пробиотика содержалось в 3,86 и 3,79 раза больше, чем в интактной группе. Они совместно с родами Lachnobacterium spp., Clostridium spp. способствуют повышению ферментации целлюлозы в просвете кишечника при использовании растительных полисахаридов рациона.
По мнению Reichardt et al. (2014), семейства Lachnospiraceae, Clostridiaceae и Bacteroidaceae включают пропионат-продуцирующие бактерии [6]. Усиленная генерация пропионата в дальнейшем может оказать важное влияние на физиологию хозяина, регулируя экспрессию генов и являясь сигнальной молекулой. Также пропионат характеризуется противовоспалительными свойствами, которые он проявляет на слизистой оболочке кишечника, а после всасывания способствует глюконеогенезу в печени и может содействовать обеспечению энергией организма.
Важно отметить высокое содержание в опытной группе представителей рода Lactobacillus spp. Количество их составило 2,05 х 107 ± 0,62 х 107 lg геномов/г и по отношению к группе контроля это больше в 2,41 раза.
Более высокое содержание рода Lactobacillus spp., характеризующегося иммуномодулирующей и антимикробной активностью, способно поддерживать необходимый уровень локальной резистентности организма. В том числе высокое кишечное изобилие лактобактерий и бифидобактерий, как правило, связано со здоровьем кишечника, поскольку представители этих родов обладают возможностью способствовать подавлению роста условно-патогенных микроорганизмов [7‒10] и оказывают иммуномодулирующее действие [11, 12].
Изменения в нормофлоре ободочного отдела кишечника численности лактат-утилизирующих бактерий выражены повышением количества бактерий родов Megasphaera spp., Veillonella spp., Dialister sрp. Так, их количество было 10,15 х 105 ± 5,17 х 105 lg геномов/г у опытных животных и 2,37 х 105 ± 0,97 х 105 ‒ у животных контрольной группы, то есть разница составила 4,28 раза. Отметим, что численное возрастание данных представителей бактерий свидетельствует об увеличении синтеза микробиотой летучих жирных кислот, которые могут использоваться на пролиферацию слизистой оболочки кишечника, а также покрывать энергопотребности макроорганизма. Кроме того, продукты жизнедеятельности лактат-утилизирующих бактерий обладают значительной антимикробной активностью в отношении патогенных форм микроорганизмов [13].
В результате увеличения полезных бактерий при применении пробиотического комплекса «ЛикваФид» отмечается сокращение части нежелательных и патогенных микроорганизмов. Так, среди условно-патогенных микроорганизмов в опытной группе число пептострептококков рода Peptostreptococcus spp. было ниже в 1,16 раза, энтеробактерий семейства Enterobacteriaceae spp. – в 1,55 раза и актиномицетов родов Mobiluncus spp., Corynebacterium spp. – в 1,08 раза, чем в интактной группе.
Представители рода Peptostreptococcus spp. всегда присутствуют в содержимом кишечника. Однако и опасность для здоровья животного от увеличения количественного состава данных бактерий или снижения резистентности организма не исключается.
Бактерии семейства Enterobacteriaceae spp. принято относить к комменсальной микробиоте свиней, но, с другой стороны, они содержат оппортунистические патогены, такие как сальмонелла или энтеротоксигенная кишечная палочка. Из этого следует, что небольшое уменьшение их количества в опытной группе может положительно сказаться на сокращении частоты возникновения заболеваний, вызванных вышеуказанными патогенами. Исследованиями Л.А. Ильиной установлено, что у свиней с низкими показателями продуктивности и склонных к проявлению патологий наблюдается повышение в различных отделах кишечника энтеробактерий, в том числе вида Salmonella enteriditis [1]. Являясь pH-чувствительными бактериями, уменьшение обилия семейства Enterobacteriaceae spp., возможно, было связанно с понижением просветного водородного показателя в ободочной кишке.
Среди патогенных микроорганизмов количество фузобактерий родов Fusobacterium spp., Sneathia spp., Leptotrichia spр., стрептококков рода Streptococcus spp. и стафилококков рода Staphylococcus spp. было ниже у свиней опытной группы, по сравнению с контрольной. Обращает внимание наличие в содержимом кишечника большого количества представителей рода Streptococcus spp., что может свидетельствовать о циркуляции стрептококковой инфекции среди поголовья свиней.
Заключение
Применение пробиотического комплекса «ЛикваФид» поросятам в период доращивания создает благоприятные условия в просвете кишечника для развития полезных микроорганизмов и снижает число нежелательных и патогенных бактерий. Количественное увеличение представителей нормофлоры родов Lachnobacterium spp., Clostridium spp., Prevotella spp., Porphyromonas spp., Eubacterium spp., Lactobacillus spp., Megasphaera spp., Veillonella spp., Dialister sрp. в микробиоме дает предпосылки для более полного использования питательных веществ основного рациона и, как следствие, положительно отразится на росте молодняка свиней.
Литература
- Ильина Л.А. Микробиом сельскохозяйственных животных, его связь со здоровьем и продуктивностью: Автореферат доктора биолог. наук/ Л.А. Ильина. Дубовицы, 2022. 40 с.
- М.В. Грязнова. Исследование микробиомного состава отделов кишечника свиней методом высокопроизводительного секвенирования/М.В. Грязнова, Ю.Д. Дворецкая, М.Ю. Сыромятников и др. Ветеринарный фармакологический вестник, 2022. №1(18). С. 69‒78. DOI: 10.17238/issn2541-8203.2022.1.69.
- Wei X., Bottoms K.A., Stein H.H., Blavi L., Bradley C.L., Bergstrom J., Knapp, J., Story R., Maxwell C., Tsai T., Zhao J. Dietary Organic Acids Modulate Gut Microbiota and Improve Growth Performance of Nursery Pigs. Microorganisms, 2021.:110 https://doi.org/10.3390/microorganisms9010110.
- Wei X., Tsai T., Knapp J., Bottoms K., Deng F., Story R., Maxwell C., Zhao J. ZnO Modulates Swine Gut Microbiota and Improves Growth Performance of Nursery Pigs When Combined with Peptide Cocktail. Microorganisms, 2020.:146 https://doi.org/10.3390/microorganisms8020146.
- Gardiner G.E., Metzler-Zebeli B.U., Lawlor P.G. Impact of Intestinal Microbiota on Growth and Feed Efficiency in Pigs: A Review. Microorganisms, 2020 8: https://doi.org/10.3390/microorganisms8121886.
- Reichardt N., Duncan S., Young P. et al. Phylogenetic distribution of three pathways for propionate production within the human gut microbiota. ISME J., 2014. 8:1323–1335. https://doi.org/10.1038/ismej.2014.14.
- O'Shea C.J. et al. Indices of gastrointestinal fermentation and manure emissions of growing-finishing pigs as influenced through singular or combined consumption of Lactobacillus plantarum and inulin.Journal of Animal Science, 2012. Vol. 90. №11. Р. 3848‒3857. https://doi.org/10.1093/ansci/91.7.3474.
- Esben Gjerlφff Wedebye Schmidt, Mogens Helweg Claesson, Simon Skjφde Jensen, Peter Ravn, Nanna Ny Kristensen. Antigen-presenting cells exposed to Lactobacillus acidophilus NCFM, Bifidobacterium bifidum BI-98, and BI-504 reduce regulatory T cell activity. Inflammatory Bowel Diseases>,Vol. 16. Issue 3. P. 390–400. https://doi.org/10.1002/ibd.21068.
- Wan Z. et al. In vitro evaluation of swine-derived Lactobacillus reuteri: Probiotic properties and effects on intestinal porcine epithelial cells challenged with enterotoxigenic Escherichia coli K88. Journal of microbiology and biotechnology, 2016. Vol. 26. №6. Р. 1018‒1025. https://doi.org/10.4014/jmb.1510.10089.
- Yang Y. et al. Feed fermentation with reuteran-and levan-producing Lactobacillus reuteri reduces colonization of weanling pigs by enterotoxigenic Escherichia coli. Applied and environmental microbiology, 2015. Vol. 81. №17. Р. 5743‒5752. https://doi.org/10.1128/AEM.01525-15.
- Kamiya T., Watanabe Y., Makino S., Kano H., Tsuji N.M. Improvement of Intestinal Immune Cell Function by Lactic Acid Bacteria for Dairy Products. Microorganisms, 2017.5: https://doi.org/10.3390/microorganisms5010001.
- Kandasamy S. et al. Lactobacilli and Bifidobacteria enhance mucosal B cell responses and differentially modulate systemic antibody responses to an oral human rotavirus vaccine in a neonatal gnotobiotic pig disease model. Gut microbes, 2014. Vol. 5. №5. Р. 639‒651. DOI: 10.4161/19490976.2014.969972.
- Yang F., Hou C., Zeng X., Qiao S. The Use of Lactic Acid Bacteria as a Probiotic in Swine Diets. Pathogens, 2015. 4:34‒45 https://doi.org/10.3390/pathogens4010034.







