В 2025 году журналу
ИСПОЛНИТСЯ
95 ЛЕТ!
ЧИТАЙТЕ
Материалы к юбилею >>>

РУБРИКИ
 Племенное дело |
 Крупный план |
 Актуально |
 Корма |
 Техническая политика |
 Событие |
 Ветеринария |
 Эксклюзивное интервью |
 Статистика |
 Выставки |
Творчество
наших читателей
ЧИТАЙТЕ
Автор С.И. КАЛИНИЧЕНКО
ГИМН СВИНЬЕ >>>
СТАТЬИ ИЗ НОМЕРА
DOI: 10.37925/0039-713X-2023-5-7-11
УДК 636.4
ФОРМИРОВАНИЕ РЕФЕРЕНТНОЙ БАЗЫ ДАННЫХ НА ПРИМЕРЕ ЧИСТОПОРОДНЫХ СВИНЕЙ ЙОРКШИР ДАТСКОЙ ГЕНЕТИКИ
Р.М. ЗАЙНУЛЛИН1, гендиректор, А.И. РУДЬ1, доктор с.-х. наук, руководитель научно-исследовательского отдела селекции животных, А.С. КОКОРЕВ1, начальник селекционного управления, Г.Г. ЮРКОВ2, руководитель проекта, 1ООО «Башкирская мясная компания», 2ООО «Ксивелью»
В статье приведена методика формирования референтной базы данных породы йоркшир датской генетики, представлены критерии для исключения генотипов из референтной базы вследствие недостоверности информации. Описаны практические задачи, которые решает племенной свинокомплекс при формировании референтной базы данных, перечислены маркеры продуктивности, которые могут быть проанализированы на ДНК-микрочипе Illumina GGP Porcine 50K.
Ключевые слова: свиноводство, генотипирование ДНК, формирование референтной базы, йоркшир, датская генетика, маркеры продуктивности.
Formation of a reference database on the example of purebred Yorkshire pigs of Danish genetics
R.M. ZAINULLIN1, general director, A.I. RUD1, doctor of agricultural sciences, head of research department of animal breeding, A.S. KOKOREV1, head of the selection department, G.G. YURKOV2, project lead, 1Bashkirskaya Myasnaya Kompaniya LLC, 2Ksivalue LLC
The article proposes a method of reference database creating for Yorkshire swine breed. Criteria of exception genotypes from reference database are created. Practical goals of pig breeding company that can be achieved by creating a reference database are described. Quantitative trait loci, which can be interpreted using Illumina GGP Porcine 50K, are listed.
Key words: pig-breeding, genotyping, reference database creating, Yorkshire breed, Danish swine genetics, quantitative trait loci.
Введение
Специалисты предприятия ООО «Башкирская мясная компания» и ООО «Ксивелью» разрабатывают систему оценки генетического потенциала, независимую от зарубежных селекционных центров [1]. Одним из этапов этой деятельности является создание референтных баз данных пород йоркшир, ландрас и дюрок датской генетики. Работа над созданием базы данных по йоркширу завершена, по ландрасу и дюроку продолжается. Учитывая новизну подобных исследований, в статье изложена информация о методике формирования референтной базы и ее практическом использовании.
Генотипирование животных производится с целью создания референтной базы данных по определенной породе или генетике. Она представляет собой базу данных фенотипов животных и ассоциированных с ними генотипов. Проведение генотипирования без наличия информации о фенотипе животного (значениях его селекционных признаков) нецелесообразно. При генотипировании необходимо охватить максимальное генетическое разнообразие популяции.
Референтная база данных должна включать в себя информацию о генотипах не менее 3000 голов [2]. В «Башкирской мясной компании» содержится 4570 чистопородных хряков и свиноматок породы йоркшир. Необходимо было отобрать из этого поголовья 3000 голов для генотипирования.
Для этой цели отбор свиноматок производился по следующим параметрам:
– все поголовье, завезенное из Дании;
– все имеющиеся в наличии хряки;
– родство с животными, информация о которых содержится в базе данных зоотехнического учета;
– наличие живых родителей животного;
– число опоросов животного и наличие потомков.
Построено генеалогическое дерево в виде графа, в качестве семейства обозначена каждая не связанная компонента этого графа. Цель – отбор свиноматок из наибольшего числа семейств, а также хотя бы одного представителя из каждого помета. Для точности оценки, понимания генетического вклада в фенотип и закономерностей их наследования необходимо генотипировать несколько поколений одного семейства. Поэтому отбор ДНК следует производить у всех особей, оставивших потомство, и их родителей. Особи без потомков, известных родителей и опоросов исключались из генотипирования.
Оставшееся поголовье свиноматок ранжировано по размеру семейства. Отдельно рассмотрены свиноматки – единственные представители собственного семейства и свиноматки – члены более крупных семейств. Такие животные интересны с точки зрения генетического разнообразия. В случае отсутствия успешных опоросов и, как следствие, фенотипических данных свиноматки исключаются из списков на генотипирование.
У свиноматок, имеющих один-два опороса, потомки с высокой степенью вероятности не достигли возраста осеменения, поэтому находятся в статусе племенного молодняка. Потомство этих свиноматок будет оценено в ходе дальнейших исследований. Свиноматки, от которых получено три и более опоросов, но не имеющие в базе данных информацию о продуктивности дочерей, будут использованы для случайного отбора.
Свиноматки ‒ члены больших семейств отбирались на генотипирование по следующим параметрам:
– все животные с живыми родителями;
– свиноматки с потомством;
– из свиноматок без потомства отобрано не менее одного представителя из каждого помета (рис. 1).
Таким образом, от каждой пары отец-мать, представленной в базе, будет генотипирован минимум один потомок. Данным критериям соответствовало 2227 животных из необходимых 3000. Недостающее поголовье набрано методом рандомного отбора. В списки включены дополнительно 200 голов из резерва на случай непредвиденного выбытия животных из приоритетного списка.
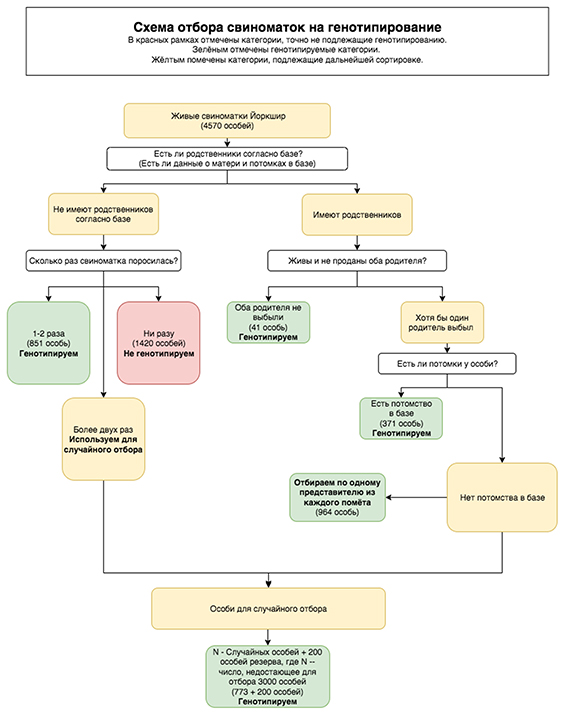
Рис. 1. Схема отбора свиноматок породы йоркшир для генотипирования
Оценка качества генотипирования
При низком уровне результатов генотипы исключаются из референтной базы. Качество результатов оценивается по двум параметрам:
– call rate – доля SNP, по которой при прочтении результатов зафиксирован сигнал [3];
– GC score – мера достоверности прочтения каждого SNP [3].
Общим правилом для ДНК-микрочипов Illumina является отбраковка результатов с call rate ниже 0,9.
Однако при валидации результатов генотипирования для маркера, который расположен на Х-хромосоме (маркер DMD), мы столкнулись с необходимостью вводить дополнительные требования. При низких значениях GC score возможна ошибочная интерпретация самца как носителя DMD, чего не может быть, так как самец несет только одну Х-хромосому. Распределение SNP, приводящих к ошибочным результатам по GC score, показано на рис. 2.
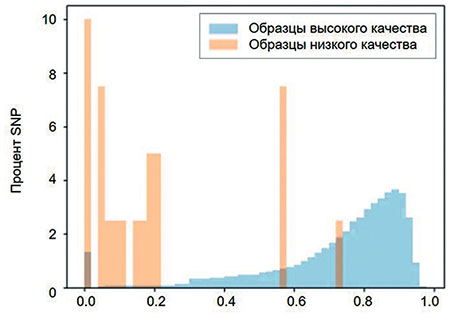
Рис. 2. Распределение ошибочных SNP при определении маркера DMD по GC score
Показатель GC score нельзя использовать как пороговое значение само по себе, так как он рассчитывается для каждого SNP. В качестве порогового значения GC score может применяться 10-квантиль данного показателя для каждого образца (10% GC score). Она показывает величину GC score для образца, ниже которой 10% SNP, выше или равно которой оставшиеся 90%. С целью определения порогового значения параметра 10% GC score построено распределение call rate образцов по 10% GC score. Пороговым значением GC score, выше которого находятся образцы с call rate 0,9, является значение 0,25 (рис. 3).
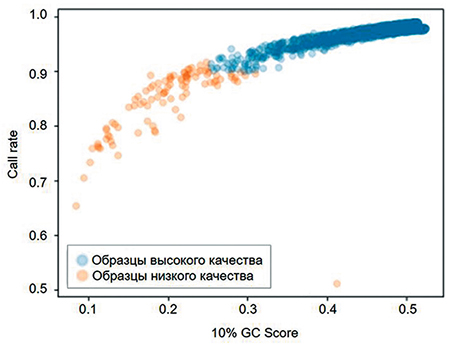
Рис. 3. Распределение call rate образцов по 10-квантили GC score
Таким образом, критерием для исключения генотипов из референтной базы является выполнение хотя бы одного из двух условий:
– Call rate ниже 0,9;
– 10% GC score ниже 0,25.
При создании референтной базы данных племенное хозяйство решает следующие задачи:
1) оценка уровня инбридинга в популяции;
2) оценка чистопородности животных;
3) оценка потенциала исследованных животных по маркерам продуктивности;
4) уточнение BLUP-оценки генетического потенциала результатами геномного анализа;
5) получение базы сравнения, с которой будут сопоставлять генотипы ремонтного молодняка до начала его производственного применения. На основании такого анализа селекционер принимает решение об использовании ремонтного животного для чистопородного разведения, получения гибридного молодняка или выбраковки.
Оценка уровня инбридинга в популяции
Инбридинг, рассчитанный на основе геномных данных, является самым точным методом из возможных. Он позволяет работать непосредственно с наблюдаемыми генотипами. Как следствие, производится расчет реального уровня инбридинга в популяции, а не его вероятностная оценка. Геномную оценку инбридинга можно строить для одного животного, наличие родословных не требуется.
Для оценки инбридинга в стадах йоркшира и ландраса в ООО «Башкирская мясная компания» использовался метод оценки инбридинга на основе идентификации протяженных гомозиготных областей (runs of homozygosity; ROH) [4]. Протяженные гомозиготные участки присутствуют в геноме особи из-за того, что оба родителя передали одинаковые гаплотипы своему потомку. Количество ROH и распределение их по размеру отражают недавние и более ранние исторические события популяции. Наличие длинных участков ROH указывает на недавнего общего предка у родителей особей, а более короткие – от дальних предков.
Коэффициент геномного инбридинга рассчитывается по формуле:
I = 100 * ROH/(2800000000/1000),
где I ‒ коэффициент инбридинга,
ROH ‒ протяженность гомозиготных участков,
2800000000 ‒ величина генома свиньи Sus scrofa.
Оценка чистопородности животных
Для определения чистопородности применена методика Genomic breed composition (GBC) based on admixture models [5]. При ее использовании выявлены подгруппы (кластеры) на основе общих и уникальных генетических вариантов между особями. У животных, принадлежащих к одному кластеру, генетическое разнообразие берет начало в одном источнике, который задается породой. Таким образом, можно определять, является ли свинья чистопородной (рис. 4). Если нет, то можно выявить, сколькими породами определяется ее генетическое разнообразие (рис. 5).
Рис. 4. Соотношение кластеров, связанных с породой, у чистопородных свиней: а – йоркшир, б – ландрас
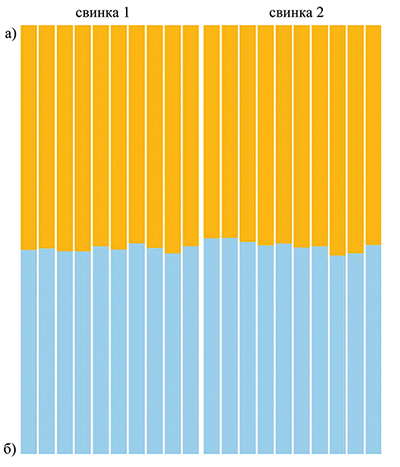
Рис. 5. Соотношение кластеров, связанных с породой, у помесных животных (F1): а ‒ йоркшир, б ‒ ландрас
Оценка потенциала исследованных животных по маркерам продуктивности
При создании референтной базы данных в «Башкирской мясной компании» использовались чипы GGP Porcine 50K. Данный чип хорошо отражает разнообразие генотипов в изученных популяциях свиней.
ДНК-микрочип GGP Porcine 50K позволяет получить следующую информацию.
О носительстве генетических болезней:
– стресс-синдром (маркер Ryr1). Белок-рецептор RYR1 отвечает за корректное функционирование скелетных мышц. Неблагоприятный аллель A обуславливает злокачественную гипертермию свиней, которая ведет к стресс-синдрому, а также потери качества мяса при малейшей тревоге, к примеру взвешивании, перемещении, спаривании;
– мембранопролиферативный гломерулонефрит II типа (маркер Factor H). Недостаток комплемент-ингибирующего фактора F, который встречается у особей с аллелем BB, ведет к тяжелой болезни почек и смерти животного в молодом возрасте;
– мышечная дистрофия Дюшенна (DMD). Мутация в гене дистрофина (аллель A) приводит к тяжелому дыханию, потере цвета кожи, снижению подвижности, стрессу животного. Иногда ведет к смерти животного во время проведения рядовых процедур.
О маркерах продуктивности:
– кальпастатин (два локуса ‒ CAST A и CAST B). Мышечный белок кальпастатин влияет на качество мяса животного. Аллель А в локусе 249 (CAST A) гена и аллель А в локусе 638 (CAST B) гена увеличивают сочность и мягкость мяса;
– нейропептид AgRP (маркер AgRP) связан с контролем аппетита и влияет на качество мяса. Мясо носителей аллеля B менее кислое, более сочное и обладает более привлекательным цветом;
– рецептор холецистокинина А (маркер ССKAR). Рецептор холицистокинина А связан с физиологией контроля аппетита и ожирения. Животные с благоприятным аллелем B в среднем на 5% больше потребляют корма, на 3% быстрее растут и требуют на 3% меньше дней для достижения массы 180 кг;
– рецептор эритропоэтина (маркер EPOR). Рецептор эритропоэтина влияет на вместимость матки животного. Из-за этого свиноматки с аллелем В гена более плодовитые;
– рецептор эстрогена (маркер ESR). Рецептор эстрогена ESR влияет на репродуктивный цикл свиней. Аллель B гена ассоциирован с повышенным числом живорожденных поросят. Гомозиготные по аллелю B особи приносят в среднем на 0,8 поросенка больше, чем гомозиготные особи по неблагоприятному аллелю AA;
– иммунитет к отечной болезни (маркер FUT1). Альфа-фукозилтрансфераза ответственна за прикрепление антигенов на поверхности клеток. Носители аллеля B становятся восприимчивы к отечной болезни, вызываемой патогенным штаммом E.coli Гомозиготные особи по аллелю A, наоборот, резистентны к заболеванию;
– гормон MC4R (маркер MC4R). Гормон MC4R контролирует аппетит свиней. Аллель А приводит к снижению конверсии корма и увеличению толщины шпика. Напротив, аллель B увеличивает конверсию корма и прирост нежирного мяса;
– субъединица гамма-3 АМФ-активируемой протеинкиназы (маркер PRKAG3_1). Хэмпширский эффект, проявляющийся в высоком содержании гликогена, нарушении цвета и кислотности, снижении сочности мяса. Признак наиболее выражен у гомозигот по аллелю B. Гомозиготы по аллелю А обладают наилучшим качеством мяса.
Использование при анализе генотипа животных информации о маркерах продуктивности позволяет уточнить его оценку.
Выводы
Референтная база данных представляет собой информационный банк фенотипов животных и ассоциированных с ними генотипов. При ее формировании максимально учтено генетическое и фенотипическое разнообразие популяции. Из базы данных исключены животные, у которых ДНК-пробы имели call rate ниже 0,9 или 10% GC score оказались меньше 0,25.
С помощью референтной базы данных возможны:
– максимально точная оценка инбредности популяции;
– выявление нечистопородных животных (даже по отдельным особям без построения родословных);
– оценка потенциала генотипированных животных по маркерам продуктивности;
– уточнение BLUP-оценки результатами геномного анализа;
– получение базы сравнения, с которой будут сопоставляться генотипы ремонтного молодняка до начала производственного использования.
Стандартный чип Illumina GGP Porcine 50K позволяет оценить генотип свиней по следующим маркерам продуктивности: Ryr1 (стресс-синдром), Factor H (наследственное поражение почек), DMD (мышечная дистрофия Дюшенна), CAST A и CAST B (качество мяса), AgRP (качество мяса), ССKAR (скорость роста), EPOR (многоплодие), ESR (повышение многоплодия), FUT1 (иммунитет к отечной болезни), MC4R (снижение конверсии корма и увеличение толщины шпика), PRKAG3 (качество мяса).
Литература
- Зайнуллин Р.М. Методика отбора проб ДНК свиней для генотипирования/Р.М. Зайнуллин, А.И. Рудь, А.С. Кокорев, Г.Г. Юрков, Н.А. Молдавская. Свиноводство, 2023. №2. С. 8‒12.
- M.A. Cleveland, J.M. Hieke. Practical implementation of cost effective genomic selection in commercial pig-breeding using imputation. J. Anim. Sсi., 2013. 91:3583‒3592.
- Infinium. Genotyping data analysis//A guide for analyzing Infinium genotyping data using the GenomeStudio® genotyping module. Technical note: Genotyping. Illumina Inc.
- F.C. Ceballos et al. Runs of homozygosity: Windows into population history and trait architecture. Nature Reviews Genetics, 2018. Vol. 19. P. 220–234.
- Ya. Wang et al. Estimation of genomic breed composition for purebred and crossbred animals using sparsely regularized admixture models. Front. in Genet., 2020. 11:576.








