В 2025 году журналу
ИСПОЛНИТСЯ
95 ЛЕТ!
ЧИТАЙТЕ
Материалы к юбилею >>>

РУБРИКИ
 Племенное дело |
 Крупный план |
 Актуально |
 Корма |
 Техническая политика |
 Событие |
 Ветеринария |
 Эксклюзивное интервью |
 Статистика |
 Выставки |
Творчество
наших читателей
ЧИТАЙТЕ
Автор С.И. КАЛИНИЧЕНКО
ГИМН СВИНЬЕ >>>
СТАТЬИ ИЗ НОМЕРА
DOI: 10.37925/0039-713X-2023-7-48-52
УДК 636.2:612.621
ВЛИЯНИЕ ГЛИЦЕРОГИДРОГЕЛЯ КРЕМНИЯ НА ПОКАЗАТЕЛИ КРИОРЕЗИСТЕНТНОСТИ ДЕВИТРИФИЦИРОВАННЫХ ООЦИТ-КУМУЛЮСНЫХ КОМПЛЕКСОВ СВИНЕЙ
Д.А. СТАРИКОВА, кандидат биолог. наук, научный сотрудник, е-mail: live8avis@mail.ru, Т.И. КУЗЬМИНА, доктор биолог. наук, профессор, е-mail: prof.kouzmina@mail.ru, лаборатория биологии развития, Всероссийский научно-исследовательский институт генетики и разведения сельскохозяйственных животных – филиал ФГБНУ «Федеральный исследовательский центр животноводства ‒ ВИЖ имени академика Л.К. Эрнста» (Санкт-Петербург, г. Пушкин)
Проведен сравнительный анализ популяции нативных и интраовариально витрифицированных с применением глицерогидрогеля кремния (ГГК) ооцит-кумулюсных комплексов (ОКК) свиней с учетом морфофункциональных показателей криорезистентности (морфология соматических и половых клеток, локализация липидных капель (ЛК) и интенсивность флюоресценции ЛК/Nile red). Выявлены криопротекторные эффекты ГГК на ооцит-кумулюсные взаимодействия и функционирование ЛК. Аргументирована возможность использования ГГК при интраовариальной витрификации женских гамет Sus scrofa domesticus.
Ключевые слова: интраовариальная витрификация, ооциты свиньи, Nile red, глицерогидрогель кремния, липидные капли.
Influence of silicon glycerohydrogel on the cryoresistence of devitrified porcine cumulus oocyte-complexes
D.A. STARIKOVA, candidate of biological sciences, researcher, е-mail: live8avis@mail.ru, T.I. KUZMINA, doctor of biological sciences, professor, e-mail: prof.kouzmina@mail.ru, developmental biology laboratory, Russian Research Institute of Farm Animal Genetics and Breeding ‒ Branch of the L.K. Ernst Federal Research Center for Animal Husbandry (St. Petersburg, Pushkin).
A comparative analysis of the population of native and intraovarially vitrified with silicon glycerohydrogel (SGH) porcine oocyte-cumulus complexes was carried out taking into account the morphofunctional indicators of cryoresistance (morphology of somatic and germ cells; localization of lipid droplets (LD) and fluorescence intensity of LD/Nile red). The cryoprotective effects of SGH on oocyte-cumulus interactions and functioning of LD were revealed. The possibility of using SGH for intraovarian vitrification of Sus scrofa domesticus oocytes is argued.
Key words: intraovarian vitrification, porcine oocytes, Nile red, silicon glycerohydrogel, lipid drioplets.
Введение
В последние десятилетия проведены обширные исследования по повышению эффективности этапов технологии криоконсервации ооцитов сельскохозяйственных животных, однако качество декриоконсервированных женских гамет все еще не соответствует качеству нативных ооцитов. Применяемые в современных научных лабораториях методы замораживания и хранения женских половых клеток сельскохозяйственных животных в криобанках призваны обеспечить высокий уровень жизнеспособности после оттаивания.
На сегодняшний день витрификация является наиболее эффективным методом заморозки ооцитов [7]. Криосохранение женских гамет внутри овариальных фолликулов, или интраовариальная витрификация, обеспечивает, в частности, снижение риска инвазии ооцитов криогенными микроорганизмами [9].
Одним из основополагающих факторов при оптимизации технологии витрификации ооцит-кумулюсных комплексов является разработка состава криопротекторных сред. Для модернизации и стандартизации криопротекторных сред используют различные естественные или синтезированные вещества, свойства которых обеспечивают криосохранность гамет и окружающих их соматических клеток [3].
В наших исследованиях оценены криопротекторные качества производного классического криопротектора глицерина – глицерогидрогель кремния. ГГК синтезирован в Институте органического синтеза имени И.Я. Постовского УрО РАН и имеет коммерческое название «Силативит». Глицерогидрогель кремния обладает транскутанной активностью, регенерирующими, ранозаживляющими и антимикробными свойствами [4]. Эффективность потенциальных криопротекторов оценивается по показателям жизнеспособности объектов, в нашем случае ооцит-кумулюсных комплексов, подвергшихся витрификации.
Цель исследования – оценить морфологию ооцит-кумулюсных комплексов Sus scrofa domesticus и показатели функционирования липидома (локализацию и интенсивность флюоресценции липидных капель, визуализированных Nile red) в женских гаметах при их интраовариальной витрификации с использованием ГГК.
Материалы и методы
В экспериментах использовали овариоэктомированные яичники шести-восьмимесячных свиней породы ландрас без видимых признаков патологии. Доставку в лабораторию производили в физиологическом растворе с антибиотиками в течение одного часа.
Яичники разделяли на фрагменты размером 15х20 мм поперечной резекцией. Витрификацию полученных фрагментов проводили в соответствии с разработанными в лаборатории протоколами [3]. Фрагменты яичников последовательно экспонировали в криопротекторных агентах (КПА): в течение 25 минут в КПА-1 (7,5% этиленгликоль (ЭГ), 7,5% диметилсульфоксид (ДМСО), 65% фосфатно-солевой буфер (ФСБ) с добавлением 2М бычьего сывороточного альбумина (БСА); 15 минут в КПА-2 (20% ЭГ, 20% ДМСО, 60% ФСБ, 1М БСА, 0,5 моль/л сахарозы).
Состав криопротекторных агентов всех экспериментальных групп дополняли ГГК в концентрациях 2%, 6%, 10%. Хранение образцов в жидком азоте при сверхнизкой температуре ‒ -196оС продолжалось не менее 24 часов. Оттаивание фрагментов яичников проводили в растворах для разморозки при температуре 38,5оС по схеме: одна минута в ФСБ с 1М БСА, 0,5 моль/л сахарозы, далее пять минут в ФСБ с 0,25 моль/л сахарозы. Для окончательного оттаивания фрагменты яичников экспонировали 10 минут в ФСБ. Нативные ОКК и ОКК из оттаянных фрагментов яичника получали путем резекции. Морфологию клеток кумулюса ОКК оценивали на микроскопе МБС-9 (увеличение 4×14).
Функциональное состояние липидома анализировали с использованием красителя Nile red для визуализации липидных капель в денудированных ооцитах. Гаметы помещали в 2 мл 1 мкM раствора Nile red на пять минут при 24оС. Затем клетки отмывали в 10 мкл ФСБ при комнатной температуре, располагали на стекле и накрывали покровным стеклом. Анализ липидома проводили на микроскопе Carl Zeiss Axio Imager А2m. С помощью программы JMicroVision 1.2.7. (цветовая модель RGB) изображения флюоресцирующих клеток, зафиксированных на фотографиях, оценивали по ИФ. Количество пикселей определенного диапазона по ИФ и превышающее половину площади клетки являлось основанием для ранжирования клеток по группам: первая – от 0 до 80, вторая – от 80 до 120, третья – от 120 до 255. Локализацию ЛК в цитоплазме ооцита определяли как периферийно-перинуклеарную, диффузную (равномерное распределение ЛК по цитоплазме ооцита), хаотичную (неравномерное распределение ЛК по цитоплазме ооцита), согласно методике F. Ariu et al. (2016) [6].
В исследованиях использовали реактивы производства фирмы Sigma-Aldrich, за исключением указанных выше. Статистическую обработку полученных данных проводили с применением критерия χ2 с помощью статистической программы Statistica 6.0. (Dell, США). Достоверность различия сравниваемых средних значений оценивали при трех уровнях значимости: P<0,05, P<0,005, P<0,001.
Результаты исследований
При разработке состава криопротекторных агентов для замораживания различных биообъектов используют глицерин или его производные в разных пропорциях. Так, например, при криоконсервации жировой ткани мышей применяли от 60% до 80% глицерина [16], а при замораживании спермы котов или баранов ‒ 3%, 5%, 7% и 6% глицерина соответственно [11, 15]. Ранее было показано, что использование в качестве добавки в состав криопротекторных сред диметилглицеролата кремния (ДМГК) в концентрации 1% наблюдали снижение уровня гранулезных клеток с пикнотическими ядрами [1], а введение 2% ДМГК в состав криопротекторных агентов увеличивало долю женских гамет с диффузным распределением липидных капель в ооцитах свиней [3].
Сравнительный анализ морфологии кумулюса (степень экспансии кумулюсных клеток) нативных ооцитов и ооцитов, подвергшихся обработке сверхнизкими температурами (интраовариальная витрификация), с введением в протоколы витрификации ГГК представлен на рисунке 1.
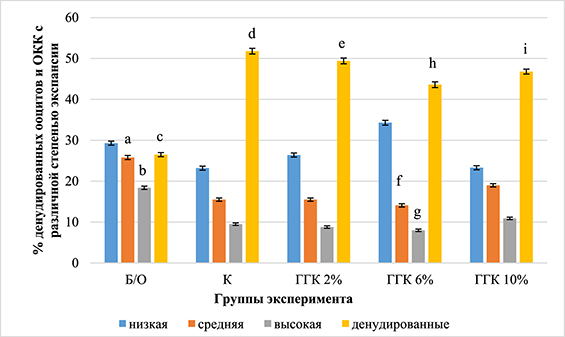
Рис. 1. Влияние сверхнизких температур на морфологию ооцит-кумулюсных комплексов свиней (доля денудированных гамет и уровень ооцитов с различной степенью экспансии кумулюса) (1200 ооцитов, три повторности)
Примечание. Здесь и далее. Группы эксперимента: Б/О – нативные фрагменты яичников; К – витрификация; ГГК 2% – витрификация с введением в КПА-2 2% ГГК; ГГК 6% – витрификация с введением в КПА-2 6% ГГК; ГГК 10% – витрификация с введением в КПА-2 10% ГГК.
Достоверные различия по критерию χ2: a:f, b:g, c:h – P<0,05, c:d – P<0,001, c:e, c:i – P<0,005.
Минимальная доля денудированных ооцитов (26,5%) выявлена в группе нативных гамет, что достоверно ниже доли девитрифицированных ооцитов без кумулюса во всех группах эксперимента как с отсутствием в протоколах витрификации ГГК (51,8%; P<0,001), так и с внесением в КПА-2 глицерогидрогелей в концентрации 2% (49,4%; P<0,005), 6% (43,6%; P<0,05), 10% (49,8%; P<0,005).
Доля ооцитов со средней степенью экспансии КК, полученных из нативных фрагментов яичника, достоверно превышала уровень интраовариально витрифицированных с 6% ГГК гамет (25,8% против 14,1% соответственно; P<0,05). Доля нативных гамет с высокой степенью экспансии была больше уровня ооцитов, выделенных из замороженных с 6% ГГК фрагментов яичника (18,4% против 8% соответственно; P<0,05).
Оценка гамет с морфологическими признаками дегенерации представлена на рисунке 2. Показано, что уровень денудированных гамет из невитрифицированных яичников (6%) достоверно ниже аналогичной доли ооцитов, выявленных после витрификации как в контрольной (31%; P<0,001), так и в опытных группах с добавлением 2% ГГК (20%; P<0,005) с добавлением 6% ГГК (18%; P<0,05). Следует отметить тенденцию к сокращению уровня морфологически дегенерированных гамет после витрификации с 30,9% в контроле до 16,3% в зависимости от процента глицерогидрогеля кремния.
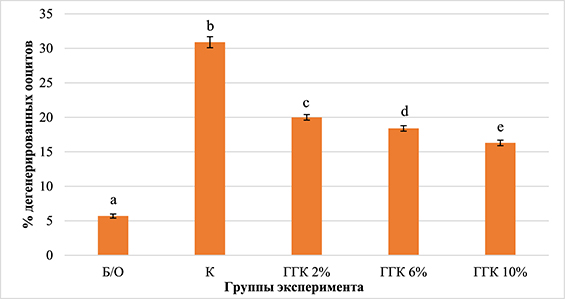
Рис. 2. Влияние сверхнизких температур на морфологию нативных и девитрифицированных ооцитов свиней (1200 ооцитов, три повторности)
Примечание. Достоверные различия по критерию χ2: a:b – P<0,001, a:c – P<0,005, a:d – P<0,05.
Представленные данные свидетельствуют о негативном влиянии сверхнизких температур на морфологию кумулюсных клеток и ооцитов. Однако модернизация состава криопротекторных сред путем введения глицерогидрогеля кремния в исследуемых концентрациях сокращает доли дегенерированных гамет после интраовариальной витрификации. Следовательно, ГГК проявляет криопротекторные свойства, возможно, из-за высокого содержания глицерина в составе криопротекторных сред.
Важным показателем качества женской гаметы является морфофункциональное состояние липидома. Среди многочисленных повреждающих структуру гаметы факторов в процессе замораживания или оттаивания особую роль играют липидные капли. Считается, что с термотропными фазовыми переходами в липидных каплях ооцитов связаны различные механизмы повреждения гаметы, которые могут оказывать влияние на функционирование липидома после витрификации [12]. Нами были изучены воздействия сверхнизких температур на морфофункциональные показатели функционирования липидных капель, а именно интенсивность флюоресценции комплекса Nile red/липидная капля (ИФЛК) (рис. 3) и локализация липидных капель в цитоплазме гаметы (рис. 4).
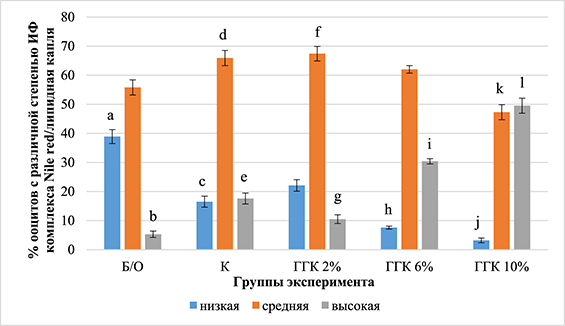
Рис. 3. Влияние ГГК на интенсивность флюоресценции комплекса Nile red/липидная капля в нативных и девитрифицированных ооцитах свиней (466 ооцитов, три повторности)
Примечание. Достоверные различия по критерию χ2: a:c, a:h, a:j, b:l, b:i, e:l, g:l – P<0,001, c:j, b:e – P<0,005, f:k – P=0,005.
Доля нативных ооцитов с низкой ИФЛК (39%) достоверно превысила уровень женских гамет, обработанных сверхнизкими температурами как в контрольной (17%), так и в опытных группах клеток с введением 6% ГГК (39% против 7%) или 10% ГГК (39% против 3,2%) (P<0,001). Также обнаружено, что доля контрольных гамет с низкой ИФЛК без обработки ГГК достоверно превышает (P<0,005) уровень девитрифицированных с 10% ГГК гамет. Доля нативных гамет с высокой ИФЛК (5,3%) оказалась достоверно ниже уровней девитрифицированных в контрольной группе (17,6%), а также при введении в КПА-2 6% ГГК (30,4%) или 10% ГГК (49,5%).
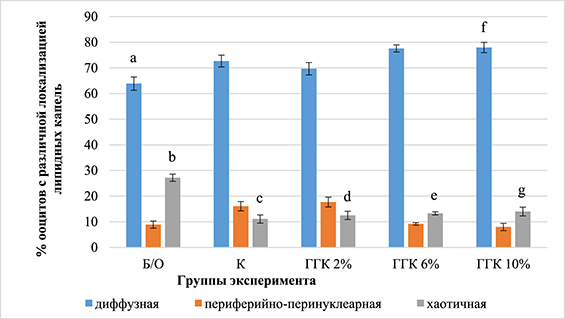
Рис. 4. Влияние ГГК на локализацию липидных капель в нативных и девитрифицированных ооцитах свиней (482 ооцита, три повторности)
Примечание: Достоверные различия по критерию χ2: a:f, b:e, b:g – P<0,005, b:c, b:d – P<0,001.
При изучении распределения липидных капель в девитрифицированных гаметах было выявлено, что в присутствии 10% ГГК в КПА-2 достоверно увеличивается доля гамет с диффузной локализацией липидных капель в сравнении с группой нативных ооцитов (78% против 63,9% соответственно; P<0,005).
Триглицериды, важнейшие составляющие липидных капель, – источник энергетических запасов клетки, используются при созревании ооцитов [5, 14]. Интенсивное расходование выражается снижением интенсивности флюоресценции Nile red в клетке. Наши результаты свидетельствуют об отсутствии утилизации триглицеридов непосредственно после оттаивания гамет. Кроме того, отмечается увеличение содержания триглицеридов в липидных каплях ооцита в зависимости от концентрации глицерогидрогеля в криопротекторе. Вероятно, при обработке криопротектором КПА-2 происходит превращение глицерина ГГК в триглицериды липидных капель ооцита, а после оттаивания гамет активизация внутриклеточных процессов, нуждающихся в АТФ, источником которых и являются триглицериды, замедляется.
Также важным показателем качества ооцитов является характер распределения липидных капель в цитоплазме ооцита. Как показано на ооцитах собак, коров и свиней, локализация является итогом контакта липидных капель с другими интрацеллюлярными органеллами [6, 10, 13]. Наши исследования доказывают, что в девитрифицированных ооцитах сразу после их оттаивания во всех группах, кроме опытной с 10% ГГК, характер локализации ЛК не отличается от нативных клеток, что предполагает отсутствие активизации интрацеллюлярных процессов взаимодействия органелл ооцита и согласуется с результатами по ИФЛК в гаметах, представленными на рисунке 3.
Заключение
В представленном исследовании проведена комплексная сравнительная оценка популяции нативных и интраовариально витрифицированных с применением глицерогидрогеля кремния ооцит-кумулюсных комплексов свиней с учетом следующих показателей криорезистентности: морфология соматических и половых клеток антральных овариальных фолликулов, локализация ЛК и интенсивность флюоресценции Nile red/липидная капля в женской гамете.
В результате введения ГГК в состав КПА-2 (20% ЭГ, 20% ДМСО, 60% ФСБ, 1М БСА, 0,5 моль/л сахарозы) обнаружены его криопротекторные эффекты, выразившиеся в снижении доли денудированных и дегенерированных ооцитов (морфологическая оценка). Эффект носил дозозависимый характер с максимально выраженным позитивным влиянием ГГК на криотолерантность исследованных объектов (ооциты, кумулюс) в концентрации 10%. При введении в КПА-2 10% ГГК возрастала доля ооцитов с диффузным распределением липидных капель, что является одним из показателей нормального функционирования липидома в созревающей гамете, как ранее писалось в наших работах и работах ряда авторов, исследующих липидом созревающих ооцитов [2, 8, 10].
Полученные результаты свидетельствуют о криопротекторных эффектах ГГК на ооцит-кумулюсные взаимодействия и функционирование липидома (липидных капель) в ооцитах свиней при воздействии сверхнизких температур, что предполагает возможность его использования при интраовариальной витрификации женских гамет Sus scrofa domesticus.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации, государственное задание №121052600350-9, тема № 0445-2021-0005.
Литература
- Алимова А.Д., Кундик Ю.В., Станиславович Т.И., Кузьмина Т.И. Влияние диметилглицеролата кремния на жизнеспособность клеток гранулезы из овариальных фолликулов Sus scrofa domesticus. Вопросы нормативно-правового регулирования в ветеринарии, 2019. №2. С. 61‒63. DOI: 10.17238/issn2072-6023.2019.2.
- Новичкова Д.А., Кузьмина Т.И., Щербак О.В., Галаган Н.П., Епишко О.А. Влияние наночастиц высокодисперсного кремнезема на морфологию и интрацитоплазматическую локализацию липидных капель в ооцитах свиней. Розведення і генетика тварин, 2017. В. 53. С. 284‒292.
- Старикова Д.А., Кузьмина Т.И. Особенности функциональной активности липидома в ооцитах Sus scrofa domesticus при интраовариальной витрификации. Аграрный вестник Урала, 2022. №12(227). С. 62‒72. DOI: 10.32417/1997-4868-2022-227-12-62-72.
- Хонина Т.Г., Чупахин О.Н., Ларионов Л.П., Бояковская Т.Г., Суворов А.Л., Шадрина Е.В. Синтез, токсичность и трансдермальная проницаемость глицератов кремния и гидрогелей на их основе. Химико-фармацевтический журнал, 2008. Т. 42. №11. С. 30‒34. DOI: https://doi.org/10.30906/0023-1134-2008-42-11-5-9.
- Amstislavsky S., Mokrousova V., Brusentsev E., Okotrub K., Comizzoli P. Influence of cellular lipids on cryopreservation of mammalian oocytes and preimplantation embryos: A review. Biopreservation and Biobanking, 2019. Vol. 17. №1. P. 76–83. DOI: 10.1089/bio.2018.0039.
- Ariu F., Strina A., Murrone O., Falchi L., Bebbere D., Ledda S., Zedda M.T., Pau S., Bogliolo L. Lipid droplet distribution of immature canine oocytes in relation to their size and the reproductive stage. Animal Science Journal = Nihon Chikusan Gakkaiho, 2016. Vol. 87(1). P. 147–150. DOI: 10.1111/asj.12432.
- Bojic S., Murray A., Bentley B.L., Spindler R., Pawlik P., Cordeiro J.L., Bauer R., de Magalhães J.P. Winter is coming: The future of cryopreservation. BMC Biol., 2021. Vol. 24. №19(1). P. 56.
- Brusentsev E.Y., Mokrousova V.I., Igonina T.N., Rozhkova I.N., Amstislavsky S.Y. Role of lipid droplets in the development of oocytes and preimplantation embryos in mammals. Russian Journal of Developmental Biology, 2019. Vol. 50. №5. P. 230‒237. DOI: 10.1134/S1062360419050102.
- Campos L.B., da Silva A.M., Praxedes E.C.G. Vitrification of collared peccary ovarian tissue using open or closed systems and different intracellular cryoprotectants. Cryobiology, 2019. №91. P. 77–83.
- Dadarwal D., Adams G.P., Hyttel P., Brogliatti G.M., Caldwell S., Singh J. Organelle reorganization in bovine oocytes during dominant follicle growth and regression. Reproductive biology and endocrinology: RB&E, 2015. Vol. 13. P. 124. https://doi.org/10.1186/s12958-015-0122-0.
- Málková A., Savvulidi F.G., Ptáček M., Machová K., Janošíková M., Nagy S., Stádník L. Glycerol-free equilibration with the addition of glycerol shortly before the freezing procedure: A perspective strategy for cryopreservation of Wallachian ram sperm. Animals (Basel), 2023. Vol. 13.№7. P. 1200. DOI: 10.3390/ani13071200.
- Okotrub K.A., Mokrousova V.I., Amstislavsky S.Y., Surovtsev N.V. Lipid droplet phase transition in freezing cat embryos and oocytes probed by raman spectroscopy. Biophysical Journal, 2018. Vol. 115. №3. P. 577‒587. DOI: 10.1016/j.bpj.2018.06.019.
- Pedersen H.S., Callesen H., Løvendahl P., Chen F., Nyengaard J.R., Nikolaisen N.K., Holm P., Hyttel P. Ultrastructure and mitochondrial numbers in pre- and postpubertal pig oocytes. Reproduction, Fertility, and Development, 2016. Vol. 28. №5. P. 586–598. https://doi.org/10.1071/RD14220.
- Romek M., Gajda B., Krzysztofowicz E., Kepczynski M., Smorag Z. New technique to quantify the lipid composition of lipid droplets in porcine oocytes and preimplantation embryos using Nile red fluorescent probe. Theriogenology, 2011. Vol. 75. №1. P. 42‒54. DOI: 10.1016/j.theriogenology.2010.06.040.
- Villaverde A.I., Fioratti E.G., Penitenti M., Ikoma M.R., Tsunemi M.H., Papa F.O., Lopes M.D. Cryoprotective effect of different glycerol concentrations on domestic cat spermatozoa. Theriogenology, 2013. Vol. 80. №7. P. 730–737. https://doi.org/10.1016/j.theriogenology.2013.06.010.
- Zhang P.Q., Tan P.C., Gao Y.M., Zhang X.J., Xie Y., Zheng D.N., Zhou S.B., Li Q.F. The effect of glycerol as a cryoprotective agent in the cryopreservation of adipose tissue. Stem Cell Research & Therapy, 2022. Vol. 13. №1. P. 152. https://doi.org/10.1186/s13287-022-02817-z.








