В 2025 году журналу
ИСПОЛНИТСЯ
95 ЛЕТ!
ЧИТАЙТЕ
Материалы к юбилею >>>

РУБРИКИ
 Племенное дело |
 Крупный план |
 Актуально |
 Корма |
 Техническая политика |
 Событие |
 Ветеринария |
 Эксклюзивное интервью |
 Статистика |
 Выставки |
Творчество
наших читателей
ЧИТАЙТЕ
Автор С.И. КАЛИНИЧЕНКО
ГИМН СВИНЬЕ >>>
СТАТЬИ ИЗ НОМЕРА
DOI: 10.37925/0039-713X-2023-8-60-64
УДК 619:616.98:599.731.1
ВЛИЯНИЕ ВЫГУЛЬНОГО СОДЕРЖАНИЯ СВИНЕЙ НА РАСПРОСТРАНЕНИЕ АЧС
Е.В. КОРОГОДИНА, заместитель руководителя группы, Д.А. ЛУНИНА, заместитель руководителя группы, Р.Р. ГАСАНОВ, кандидат биолог. наук, начальник группы, Самарский научно-исследовательский ветеринарный институт – филиал ФГБНУ «Федеральный исследовательский центр вирусологии и микробиологии»
Африканская чума свиней (АЧС) является одной из наиболее сложных и значимых с санитарно-экономической точки зрения болезней, поражающих в настоящее время мировое свиноводство. Когда АЧС проникает в интактную популяцию домашних свиней, она вызывает высокие показатели летальности, достигающие 95–100%. Отсутствие лечения и вакцин снижает эффективность контроля и мероприятий по искоренению АЧС, поэтому быстрое выявление вспышек и введение строгих санитарных мер являются наиболее важными инструментами борьбы с этим заболеванием.
Система выгульного содержания свиней может способствовать распространению АЧС, так как она предполагает более свободный доступ животных к контаминированным объектам окружающей среды и больным особям. В таких условиях заболевание может быстро передаваться, особенно если свиньи контактируют с зараженными дикими кабанами. Для предотвращения распространения АЧС необходимо принимать комплексные меры, включая повышение уровня биобезопасности свиноводческих предприятий, а также соблюдение правил перемещения животных.
Ключевые слова: свиноводство, африканская чума свиней, выгульное содержание, биобезопасность, факторы риска, дикий кабан.
Impact of free-range keeping of pigs on the spread of ASF
E.V. KOROGODINA, deputy head of the group, D.A. LUNINA, deputy head of the group, R.R. GASANOV, candidate of biological sciences, team leader, Federal Research Center for Virology and Microbiology ‒ Branch in Samara
African Swine Fever (ASF) is one of the most challenging swine diseases that has a significant impact on global pig farming from both sanitary and economic perspectives. The virus causes mortality rates of up to 95‒100% when it enters a population of domestic pigs, and the absence of treatment and vaccines makes controlling and eradication of ASF a challenging task. Therefore, rapid outbreak detection and strict sanitary measures are crucial tools in combating the disease.
Free-range pig farming systems can increase the risk of ASF spreading as pigs have more access to the environment and other animals. This can lead to the disease rapidly spreading, especially if infected wild boars come into contact with domestic pigs. To prevent the spread of ASF, it is necessary to implement comprehensive measures, including increasing the level of biosecurity on pig farms and strict compliance with the rules for animal transportation.
Key words: pig farming, African Swine Fever, free-range farming, biosecurity, risk factors, wild boar.
Введение
Африканская чума свиней ‒ это вирусное заболевание, поражающее домашних свиней и диких кабанов (Sus scrofa) всех возрастов и полов. Болезнь остается актуальной с 1921 года и в настоящее время угрожает их мировой популяции [10, 29].
Вирус АЧС ‒ уникальный вирус семейства Asfarviridae, единственный известный ДНК-арбовирус. У инфицированных хозяев он реплицируется в мононуклеарных клетках и имеет специфическую систему уклонения от иммунитета. Это приводит к сложностям в разработке эффективных и безопасных вакцин [13, 29].
Несмотря на усилия по созданию вакцины против АЧС, в настоящее время доступны только меры контроля распространения и ликвидации очагов болезни, основанные на соблюдении строгих санитарных правил, раннем выявлении и в случае возникновения болезни – депопуляции как домашних свиней, так и диких кабанов. Однако быстрое распространение АЧС по всему миру показывает, что этих действий явно недостаточно для контроля сложившейся ситуации с пандемией [32].
Распространение хорошо приспособленного к репликации в хозяевах вируса в лесном цикле Африки в другие регионы, с другими хозяевами, климатическими условиями и системами содержания свиней выявило разнообразные эпидемиологические сценарии распространения инфекции, а также множественные проблемы контроля. Большинство изолятов, циркулирующих в Европе, Азии, и в том числе в Российской Федерации, вызывают острую форму болезни [13].
До недавнего времени эпизоотический процесс АЧС характеризовался тремя независимыми эпизоотическими циклами ‒ лесной, клещево-свиной и домашний, в которых фигурируют мягкие виды клещей Ornithodoros spp., дикие африканские свиньи (в основном бородавочники), домашние свиньи и продукты, полученные из свинины. На сегодняшний день с учетом распространения АЧС в Центральной и Восточной Европе выявлен дополнительный эпизоотологический цикл с участием евразийского дикого кабана (Sus scrofa) и его среды обитания [11].
По оценкам Продовольственной и сельскохозяйственной организации ООН (ФАО), 40% мировой стоимости сельскохозяйственной продукции приходится на животноводство [17]. Болезни, одновременно поражающие домашних и диких животных, становятся все более сложной задачей для ветеринарных служб, при этом АЧС входит в тройку наиболее серьезных болезней [31].
Всемирная организация по охране здоровья животных (ВОЗЖ) выпустила отчет «Глобальная ситуация с АЧС», в котором указывалось, что с 2016 года наблюдается заметная тенденция к росту числа вспышек АЧС по всему миру. Это заболевание наносит огромный ущерб свиноводству, который складывается непосредственно из-за гибели свиней, а также косвенно из-за ограничений на торговлю живыми животными и свиноводческой продукцией как на внутреннем рынке, так и в рамках международных торговых отношений [19]. К значительным экономическим потерям также могут привести мероприятия по ликвидации и недопущению распространения АЧС, в том числе соблюдение строгих санитарных мер, включающих депопуляцию инфицированных и контактировавших с ними восприимчивых животных [24].
В Китае, с момента первой регистрации в августе 2018 года, вспышки АЧС наносят серьезный ущерб свиноводству и приводят к значительному сокращению производственных мощностей [12]. Согласно данным Национального бюро статистики КНР, в 2019 году поголовье живых свиней и производство свинины сократились по сравнению с предыдущим годом на 21,6% и 21,3% соответственно [21, 34].
В настоящее время Российская Федерация является страной стационарно неблагополучной по АЧС с эндемическим характером этого заболевания. С момента ее появления по декабрь 2022 года на территории РФ зарегистрировано 2212 вспышек в 66 регионах. В течение этого времени экономический ущерб от данной болезни оценивается более чем в 70 млрд рублей [2].
По официальным данным ФГБУ «Центр ветеринарии», в России с 2007 года на свиноводческие предприятия (с поголовьем свыше 5000 голов) приходится только около 6,0% от всех зарегистрированных очагов АЧС. Однако основная часть уничтоженных свиней в 2020‒2022 годах приходится на предприятия с поголовьем свыше 50 тыс., где за одну вспышку уничтожается в среднем около 64 тыс. животных. (табл.).
Таким образом, экономический ущерб почти на 97% состоит из потерь крупных свиноводческих предприятий, однако повышенному риску интродукции АЧС подвергаются небольшие свинофермы с недостаточной организацией биобезопасности. Кампании по информированию и просвещению должны быть ориентированы именно на такие небольшие хозяйства.
Таблица. Количество уничтоженных животных в хозяйствах РФ с различной численностью поголовья свиней в 2020–2022 годах
Поголовье, гол. |
Уничтожено, голов |
Кол-во вспышек |
Среднее количество уничтоженных голов на вспышку |
>50 000 |
583 409 |
9 |
64 823,2 |
10 000‒50 000 |
477 242 |
20 |
23 862,1 |
5001‒10 000 |
26 915 |
4 |
7403,8 |
1001‒5000 |
20 053 |
10 |
2005,3 |
501‒1000 |
1797 |
3 |
599,0 |
101‒500 |
8877 |
38 |
233,6 |
51‒100 |
2576 |
36 |
71,6 |
11‒50 |
3072 |
126 |
24,4 |
≤10 |
744 |
236 |
3,2 |
Исходя из вышеизложенного, можно говорить о необходимости дальнейшего изучения процессов и факторов распространения вируса АЧС в мире, в том числе в личных подсобных хозяйствах, использующих выгульную систему содержания свиней.
Целью данного обзора является рассмотрение влияния выгульного содержания свиней на распространение АЧС.
Материалы и методы исследований
В соответствии с целью систематического обзора изучены данные источников по стратегиям контроля, расследованию вспышек, эпизоотической ситуации по АЧС. Материалы для анализа были получены путем запроса библиографических баз данных, научных электронных библиотек с поисковыми системами Web of Science (http://www.webofscience.com), Scopus (https://www.scopus.com), eLIBRARY.RU (https://www.elibrary.ru), PubMed (https://pubmed.ncbi.nlm.nih.gov), Google Scholar (https://scholar.google.ru/). Дополнительные документы были найдены посредством ручного поиска на порталах Россельхознадзора и в справочных правовых системах РФ.
Результаты исследований и их обсуждение
Исторически вспышки АЧС в Европе, СССР и странах Карибского бассейна были вызваны штаммами вируса АЧС 1-го генотипа [28]. Считается, что к проникновению вируса за пределы его африканского ареала распространения в Европу в 1957 году, а затем в Карибский бассейн и Южную Америку в 1978 году привело перемещение свинины, зараженной вирусом АЧС. После первой интродукции вируса АЧС в Европу он распространился среди домашних свиней, иногда он также передавался диким кабанам [4, 6, 14].
Вирус АЧС является эндемичным в большинстве стран Африки и на Сардинии. Остров Сардиния ‒ единственный регион за пределами Африки, оставшийся зараженным АЧС с 1978 года, с момента заноса болезни на европейский континент [18, 26, 30]. В данном случае сохранение болезни связано с высокой плотностью популяции диких кабанов и традиционным выгульным способом содержания свиней. Содержащиеся на свободном выгуле свиньи делят среду обитания с дикими кабанами, которые могут служить резервуаром вируса АЧС, а контакт с ними является путем передачи вируса между этими видами животных. Такие взаимодействия могут объяснить эндемичность АЧС на острове. Также они подтверждают необходимость ликвидации данного метода разведения свиней, что можно рассматривать как важную меру борьбы с распространением вируса АЧС [10].
Современная эпизоотия АЧС в республиках Кавказа, России и Восточной Европы началась с интродукции вируса АЧС 2-го генотипа в Грузию в 2007 году [28]. После этого вирус распространился в Европе и Азии. В отличие от предыдущих интродукций, наблюдавшихся в ХХ веке, в настоящее время кабаны играют важную эпизоотологическую роль. Заболевание возникает в виде самоподдерживающихся инфекционных циклов в популяциях диких кабанов без вовлечения клещей-переносчиков или домашних свиней [33].
В августе 2018 года болезнь достигла Китая ‒ крупнейшего в мире производителя свинины ‒ и в настоящее время распространяется в азиатских странах. В 2020 году инфицированию подверглись Индия и Папуа ‒ Новая Гвинея. За последние годы АЧС приобрела беспрецедентное распространение и значение [7]. Несмотря на проводимые меры профилактики и борьбы, АЧС продолжает свое географическое проникновение в страны Европы [9, 27] (рис.).
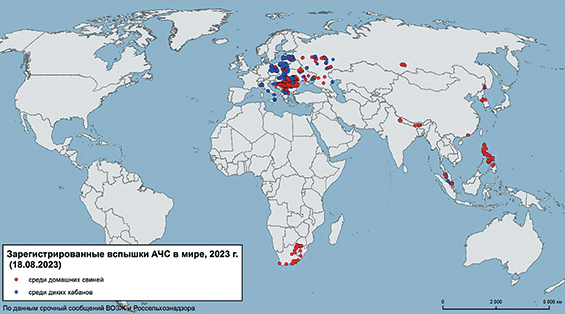
Рис. Эпизоотическая ситуация по АЧС в мире в 2023 году
В России первые случаи АЧС зарегистрированы в ноябре 2007 года у диких кабанов в Северо-Кавказском регионе [25, 33]. Инфицирование домашних свиней вирусом АЧС было зафиксировано в 2008 году, когда пострадало свиноводческое хозяйство с выгульной системой содержания животных. В дальнейшем произошел обратный занос вируса в популяцию диких кабанов вследствие низкой биобезопасности свиноводческих хозяйств, а также утилизации зараженного материала незаконными способами [33].
Основными факторами прогрессирующего распространения АЧС в Российской Федерации послужили незаконный оборот продуктов из свинины, скармливание термически необработанных пищевых отходов, практика содержания свиней на свободном выгуле и отсутствие надлежащего ветеринарного обслуживания свиней в мелких подсобных хозяйствах [20].
Большую роль в распространении АЧС в России играет человеческий фактор. Небезопасно утилизированные туши инфицированных свиней являются постоянным источником интродукции вируса АЧС в популяцию диких кабанов и обратному заражению домашних свиней [33].
К сожалению, не всегда можно с уверенностью определить путь внедрения вируса. Основную роль в предотвращении интродукции и распространения АЧС в отсутствие вакцины играет биобезопасность [3, 7].
Проанализировав научные источники, можно говорить о вкладе инфицированных диких кабанов в распространение вируса АЧС среди домашних свиней. Диким кабанам вирус АЧС может передаваться при контакте с инфицированными дикими кабанами, тушами погибших свиней, утилизированными ненадлежащим образом, а также с зараженными свиньями на свободном выгуле [22]. Экспериментальные исследования показывают, что прямой контакт домашних свиней с инфицированными дикими кабанами является эффективным путем передачи вируса и основным фактором риска возникновения новых вспышек АЧС [33].
К факторам потенциального риска заражения и распространения вируса АЧС на уровне фермы относятся низкий уровень биобезопасности, деятельность человека, факторы окружающей среды, плотность стада, а также применение системы содержания свиней на свободном выгуле [22].
Система содержания свиней ‒ это совокупность применяемых способов и форм размещения свиней в помещениях, лагерях и на пастбищах для создания оптимальных условий внешней среды и увеличения продуктивности животных.
В свиноводстве существуют две системы содержания животных ‒ выгульная и безвыгульная. Выгульная система содержания предусматривает доступ свиней на площадки или в загоны [22]. В странах Европы практикуется ряд различных типов традиционного содержания свиней с использованием свободного выгула, включая огороженные и неогороженные участки в лесах, на пастбищах или полях, открытые здания с неограниченным доступом к огороженным дворам и закрытые здания с контролируемым доступом к огороженным дворам или прогонам [16].
Выгул животных на свежем воздухе и активный моцион оказывают благоприятное воздействие на организм свиней, а потребление зеленого корма снижает себестоимость продукции. Однако при данной системе содержания повышается риск заражения АЧС путем прямого контакта восприимчивого поголовья свиней с инфицированными дикими кабанами. Кроме того, фактором риска является численность диких кабанов, небольшое расстояние между фермами и местами обитания кабана и выращивание сельскохозяйственных культур вблизи ферм, что может привлечь животных [22]. При выращивании свиней с использованием выгульного содержания очень трудно контролировать прямые и косвенные контакты между дикими кабанами и домашними свиньями [4, 10, 15, 23]. В пастбищных системах или лесных районах домашние и дикие виды занимают одно и то же пространство, что создает потенциальные риски перекрестной передачи патогенов [8].
Как подчеркивается в источниках, вероятность контактов между дикими кабанами и домашними свиньями на выгульном содержании достаточна для передачи вируса АЧС и последующего заражения. Прямые контакты между свиньями и дикими кабанами встречаются реже, чем непрямые, особенно в местах водопоя или кормления. Такие взаимодействия чаще происходят в определенные периоды года, что может быть связано с доступом к воде и сезонным пищевым ресурсам. Половые контакты дикого кабана и домашней свиньи также могут быть, если домашние свиньи не кастрированы [4, 10, 23].
Общей проблемой хозяйств, применяющих систему содержания животных со сводным выгулом, является ненадлежащее соблюдение внутрихозяйственных мер биобезопасности, в частности при дезинфекции спецодежды, передвижении и дезобработке транспортных средств, а также нарушения при ведении учета. Практически невозможно следовать требованиям биобезопасности в районах, где практикуется использование общих пастбищ (например, таких, как муниципальные пастбища на Сардинии или леса Грузии и Армении). Способом снижения риска прямого контакта свиней с инфицированными животными и зараженными пастбищами может послужить ограждение, но реализовать и поддерживать это очень сложно [5, 16].
Наиболее часто определяемыми категориями для потенциальных факторов риска на протяжении всей истории АЧС были окружающая среда, животноводство и перемещение, в том числе движение транспортных средств и перемещение зараженных продуктов. Это также согласуется с тем, что АЧС описывается как экологическое заболевание [4, 6, 14].
На территории Российской Федерации в соответствии с «Ветеринарными правилами содержания свиней в целях их воспроизводства, выращивания и реализации», утвержденными приказом Минсельхоза России от 21 октября 2020 года №621, запрещено выгульное содержание свиней. Содержать животных необходимо на огороженных территориях в закрытых помещениях без свободного выгула, не допуская контакта с животными из других хозяйств [1]. Это самая важная мера профилактики АЧС в личных подсобных и крестьянско-фермерских хозяйствах.
В европейских странах существует ряд мер биобезопасности для свиноферм со свободным выгулом, которые могут снизить риск интродукции и распространения вируса АЧС. По литературным данным, использование ограждений, защищающих от диких кабанов, является мерой биологической безопасности, которая с большой вероятностью сократит риск заноса АЧС на свиноводческие фермы с выгульным содержанием свиней [23]. Было обнаружено, что опасность проникновения диких кабанов на открытые фермы возрастает с увеличением расстояния между открытым загоном и фермой, а также в случае плохой защиты загона [16].
Как пример успешной ликвидации АЧС можно рассмотреть период с 1985 по 1995 год в Испании. В рамках Национальной программы по ликвидации АЧС там был реализован широкий спектр мер. Мероприятия включали улучшение биобезопасности и санитарно-гигиенических условий свиноферм. Было проведено уничтожение животноводческих помещений с ненадлежащими санитарными условиями и строительство металлических ограждений радиусом 100 м вокруг животноводческих сооружений, которые соответствуют требованиям биобезопасности, исключая контакт домашних свиней с дикой природой. Установлен контроль за популяциями диких кабанов, а также произведена перепись свиноводческих хозяйств и производителей свиноводческой продукции [16, 23].
На основании проанализированных научных источников можно сформулировать несколько ключевых мер биобезопасности, рекомендованных в странах Европы для хозяйств с выгульным содержанием свиней:
- проведение ежегодной оценки и получение заключения ветеринарной службы о соответствии условий биобезопасности хозяйства (проводится для выявления основных факторов риска прямых или косвенных контактов с диким кабаном);
- оборудование двойного ограждения, которое предотвращает любой неконтролируемый проход животных, людей или транспортных средств, а также контакт с дикими кабанами. Ограждения должны быть высотой не менее 1,5 м, прикрепленные к земле, расстояние между рядами должно составлять не менее 1,5 м;
- соответствие местоположения фермы установленным законом минимальным расстояниям от источников риска (ферм, скотобоен, перерабатывающих цехов и т.д.);
- в хозяйствах со свободным выгулом свиней должны быть предусмотрены пустые помещения для закрытого содержания животных в условиях возникновения заболеваний в данном муниципальном районе;
- в хозяйствах должны быть соответствующие помещения для безопасного хранения корма и подстилки (включая навоз) для исключения доступа к ним диких кабанов;
- должна быть оборудована система сбора и хранения павших животных, исключая доступ диких кабанов и других животных;
- необходимо оборудовать помещения для содержания свиней на карантине;
- организация ограниченного и безопасного доступа в хозяйство людей и транспортных средств;
- в муниципальных районах с расположенными в них хозяйствами с выгульным содержанием свиней должны быть оборудованы специализированные бойни.
Также рекомендованы все стандартные меры биобезопасности на территории таких хозяйств [16].
Заключение
Распространение АЧС оказывает серьезное воздействие на эколого-социальные системы и приводит к экономическим и социальным последствиям. Всестороннее понимание факторов риска распространения АЧС необходимо для эффективного контроля заболевания. Отсутствие эффективных вакцин против АЧС ограничивает возможности ведения болезни. Выявление и минимизация факторов риска, связанных с АЧС, имеет решающее значение для предотвращения вспышек АЧС.
Стандартной стратегии контроля АЧС, которую можно было бы применять повсеместно, не существует. Подходящие меры должны быть выбраны из множества вариантов и адаптированы к конкретной эпизоотической ситуации, а также к экологическим и социальным факторам.
При определении стратегии борьбы с АЧС нельзя недооценивать роль диких кабанов. Также эффективная политика профилактики и контроля АЧС должна учитывать особенности систем свиноводства. Основные принципы передачи инфекционных заболеваний указывают на то, что чем выше плотность восприимчивых животных и уровень прямых или косвенных контактов, тем быстрее происходит распространение заболевания, поэтому необходимо применение профилактических мер для контроля возможных путей передачи вируса от диких кабанов домашним свиньям и обратно.
Мероприятия по искоренению АЧС, такие как своевременное выявление и ликвидация очагов этого заболевания в дикой природе и свиноводстве, регулирование численности диких кабанов, повышение биобезопасности промышленных свинокомплексов и личных подсобных хозяйств должны основываться на согласованных действиях всех участников процесса ‒ ветеринарных врачей, владельцев животных, предприятий по убою и переработке свиноводческой продукции, представителей охотничьих и природоохранных организаций и др.
На основании вышеизложенного можно говорить о далеко не последней роли выгульного содержания свиней в межвидовой передаче вируса и распространении АЧС. Ученые подчеркивают, что данная область требует проведения дальнейших исследований, в том числе изучения контакта между домашними свиньями и дикими кабанами.
Литература
- Ветеринарные правила содержания свиней в целях их воспроизводства, выращивания и реализации, утвержденные приказом Минсельхоза России от 21 октября 2020 года №621. https://docs.cntd.ru/document/566135224.
- Эпизоотическая ситуация по АЧС: Хронология. Россельхознадзор: официальный сайт. https://fsvps.gov.ru/fsvps-docs/ru/iac/asf/2021/01-21/04.pdf.
- Ata E.B., Li Z.J., Shi C.W., Yang G.L., Yang W.T., Wang C.F. African Swine Fever virus: A raised global upsurge and a continuous threaten to pig husbandry. Microb. Pathog., 2022. 167:105561. DOI: 10.1016/j.micpath.2022.105561. Epub 2022 May 6. PMID: 35526679.
- Bacigalupo S.A., Dixon L.K., Gubbins S. et al. Wild boar visits to commercial pig farms in southwest England: Implications for disease transmission. Eur. J. Wildl. Res., 2022. 68:69. https://doi.org/10.1007/s10344-022-01618-2.
- Bellini S., Rutili D. & Guberti V. Preventive measures aimed at minimizing the risk of African Swine Fever virus spread in pig farming systems. Acta Vet. Scand., 2016. 58:82. https://doi.org/10.1186/s13028-016-0264-x.
- Bergmann H., Dups-Bergmann J., Schulz K., Probst C., Zani L., Fischer M., Gethmann J., Denzin N., Blome S., Conraths F.J., Sauter-Louis C. Identification of risk factors for African Swine Fever: A systematic review. Viruses, 2022. 14(10):2107. DOI: 10.3390/v14102107. PMID: 36298662; PMCID: PMC9611626.
- Blome S., Franzke K., Beer M. African Swine Fever: A review of current knowledge. Virus Res., 2020. 287:198099. DOI: 10.1016/j.virusres.2020.198099. Epub 2020 Aug 2. PMID: 32755631.
- Bosch J., Iglesias I., Muñoz M.J., de la Torre A. A cartographic tool for managing African Swine Fever in Eurasia: Mapping wild boar distribution based on the quality of available habitats. Transbound Emerg. Dis.: John Wiley & Sons Ltd, 2017. 64:1720–1733. 10.1111/tbed.12559.
- Bosch J., Rodríguez A., Iglesias I., Muñoz M.J., Jurado C., Sánchez-Vizcaíno J.M. et al. Update on the risk of introduction of African Swine Fever by wild boar into disease-free European Union countries. Transbound Emerg. Dis., 2016. DOI: 10.1111/tbed.12527.
- Cadenas-Fernández E., Sánchez-Vizcaíno J.M., Pintore A., Denurra D., Cherchi M., Jurado C., Vicente J., Barasona J.A. Free-ranging pig and wild boar interactions in an endemic area of African Swine Fever. Front. Vet. Sci., 2019. 6:376. DOI: 10.3389/fvets.2019.00376. PMID: 31737649; PMCID: PMC6831522.
- Chenais E., Depner K., Guberti V., Dietze K., Viltrop A., Stahl K. Epidemiological considerations on African Swine Fever in Europe 2014–2018. Porcine Health Manag., 2019. 5:6.
- ASFV may affect pork for several years. China Daily.com.cn. https://www.chinadailyhk.com/articles/123/102/141/1568173270206.html
- Dixon L.K., Stahl K., Jori F., Vial L., Pfeiffer D.U. African Swine Fever epidemiology and control. Annu. Rev. Anim. Biosci., 2020. 8:221‒246. DOI: 10.1146/annurev-animal-021419-083741. Epub. 2020. Nov 19. PMID: 31743062.
- Dixon L.K., Sun H., Roberts H. African Swine Fever. Antiviral Res., 2019. 165:34‒41. DOI: 10.1016/j.antiviral.2019.02.018. Epub 2019. Mar 2. PMID: 30836106.
- European Food Safety Authority (EFSA), Nielsen S.S., Alvarez J., Bicout D.J., Calistri P. et al. ASF exit strategy: Providing cumulative evidence of the absence of African Swine Fever virus circulation in wild boar populations using standard surveillance measures. EFSA J., 2021. 19(3):e06419. DOI: 10.2903/j.efsa.2021.6419. PMID: 33717352; PMCID: PMC7926520.
- EFSA Panel on Animal Health and Welfare (AHAW), Nielsen S.S., Alvarez J., Bicout D.J. et al. African Swine Fever and outdoor farming of pigs. EFSA J., 2021. 19(6):e06639. DOI: 10.2903/j.efsa.2021.6639. PMID: 34140998; PMCID: PMC8188572.
- FAO. 2019. http://www.fao.org/animal-production/en.
- Gallardo M.C., De la Torre A., Fernández-Pinero J., Iglesias I., Muñoz M.J., Arias M.L. African Swine Fever: A global view of the current challenge. Porc. Heal. Manag. Porcine Health Management, 2015. 1:21. 10.1186/s40813-015-0013-y.
- Gavier-Widén D., Stahl K., Dixon L. No hasty solutions for African Swine Fever. Science, 2020. 367:4‒622. DOI: 10.1126/science.aaz8590.
- Gogin A., Gerasimov V., Malogolovkin A., Kolbasov D. African Swine Fever in the North Caucasus region and the Russian Federation in years 2007‒2012. Virus Res., 2013. 173(1):198‒203. DOI: 10.1016/j.virusres.2012.12.007. Epub. 2012. Dec 22. PMID: 23266725.
- Gong L., Xu R., Wang Z., Deng Q., Wang H., Zhang G. African Swine Fever recovery in China. Vet. Med. Sci., 2020. DOI: 10.1002/vms3.299.
- Guinat C., Gogin A., Blome S., Keil G., Pollin R., Pfeiffer D.U., Dixon L. Transmission routes of African Swine Fever virus to domestic pigs: Current knowledge and future research directions. Vet. Rec., 2016. 178(11):7‒262. DOI: 10.1136/vr.103593. PMID: 26966305; PMCID: PMC4819659.
- Hart A., Rowe G., Bolger F. & Colson A. Expert knowledge elicitation on African Swine Fever and outdoor farming of pigs. EFSA Supporting Publications, 2021. 18(6). https://doi.org/10.2903/sp.efsa.2021.en-6595.
- Jurado C., Martínez-Avilés M., De La Torre A., Štukelj M., de Carvalho Ferreira H.C., Cerioli M. et al. Relevant measures to prevent the spread of African Swine Fever in the European Union domestic pig sector. Front. Vet. Sci., 2018. 5:77. DOI: 10.3389/fvets.2018.00077.
- Kolbasov D., Titov I., Tsybanov S., Gogin A., Malogolovkin A. African Swine Fever virus, Siberia, Russia, 2017. Emerg. Infect. Dis., 2018. 24(4):796‒798. DOI: 10.3201/eid2404.171238. PMID: 29553323; PMCID: PMC5875268.
- Laddomada A., Rolesu S., Loi F., Cappai S., Oggiano A., Madrau M.P. et al. Surveillance and control of African Swine Fever in free-ranging pigs in Sardinia. Transbound Emerg. Dis., 2019. P. 1–6. 10.1111/tbed.13138.
- Ma J., Chen H., Gao X., Xiao J., Wang H. African Swine Fever emerging in China: Distribution characteristics and high-risk areas. Prev. Vet. Med.: Elsevier B.V., 2020. P. 175.
- Malik Y.S., Singh R.K. & Yadav M.P. (eds.). Emerging and transboundary animal viruses. Livestock Diseases and Management, 2020. DOI:10.1007/978-981-15-0402-0.
- Malogolovkin A., Kolbasov D. Genetic and antigenic diversity of African Swine Fever virus. Virus Res., 2019. 271:197673. DOI: 10.1016/j.virusres.2019.197673. Epub. 2019. Jul 19. PMID: 31330205.
- Mur L., Sánchez-Vizcaíno J.M., Fernández-Carrión E., Jurado C., Rolesu S., Feliziani F. et al. Understanding African Swine Fever infection dynamics in Sardinia using a spatially explicit transmission model in domestic pig farms. Transbound Emerg. Dis.: Wiley/Blackwell, 2017. 65:1–12. 10.1111/tbed.12636.
- OIE. History. 2019. http://www.oie.int/about-us/history.
- Sánchez E.G., Pérez-Núñez D., Revilla Y. Development of vaccines against African Swine Fever virus. Virus Res., 2019. 265:150‒155. DOI: 10.1016/j.virusres.2019.03.022. Epub. 2019. Mar 25. PMID: 30922809.
- Sauter-Louis C., Conraths F.J., Probst C., Blohm U., Schulz K., Sehl J., Fischer M., Forth J.H., Zani L., Depner K., Mettenleiter T.C., Beer M., Blome S. African Swine Fever in wild boar in Europe: A review. Viruses, 2021. 13(9):1717. DOI: 10.3390/v13091717. PMID: 34578300; PMCID: PMC8472013.
- Tao D., Sun D., Liu Y., Wei S., Yang Z., An T., Shan F., Chen Z., Liu J. One year of African Swine Fever outbreak in China. Acta Trop., 2020. 211:105602. DOI: 10.1016/j.actatropica.2020.105602.








