В 2025 году журналу
ИСПОЛНИТСЯ
95 ЛЕТ!
ЧИТАЙТЕ
Материалы к юбилею >>>

РУБРИКИ
 Племенное дело |
 Крупный план |
 Актуально |
 Корма |
 Техническая политика |
 Событие |
 Ветеринария |
 Эксклюзивное интервью |
 Статистика |
 Выставки |
Творчество
наших читателей
ЧИТАЙТЕ
Автор С.И. КАЛИНИЧЕНКО
ГИМН СВИНЬЕ >>>
СТАТЬИ ИЗ НОМЕРА
DOI: 10.37925/0039-713X-2025-3-33-36
УДК 543.544:615.24:615.283:637.5
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ МЕТРОНИДАЗОЛА И ДИМЕТРИДАЗОЛА В СВИНИНЕ ХРОМАТОГРАФИЧЕСКИМИ МЕТОДАМИ
К.Е. БУРКИН, кандидат техн. наук, ст. научный сотрудник, А.З. МУХАРЛЯМОВА, кандидат биолог. наук, научный сотрудник, А.Г. МУХАММЕТШИНА, мл. научный сотрудник, А.М. САЙФУТДИНОВ, кандидат хим. наук, вед. научный сотрудник, лаборатория физико-химического и прецизионного анализа, Федеральный центр токсикологической, радиационной и биологической безопасности, e-mail: fizhimlab5@yandex.ru
В статье представлены результаты проведенных исследований по определению содержания остаточных количеств препаратов, применяемых для лечения и профилактики желудочно-кишечных заболеваний, группы 5-нитроимидазолов – метронидазола и диметридазола в образцах свинины, реализуемой населению в Республике Татарстан.
В ряде образцов обнаружили присутствие метронидазола. Дополнительно с помощью скринингового метода выявили наличие следовых количеств диметридазола в одном из образцов мяса.
Ключевые слова: метронидазол, диметридазол, свинина, высокоэффективная жидкостная хроматография, масс-спектрометрия.
Determination of metronidazole and dimethridazole content in pork by chromatographic methods
K.E. BURKIN, candidate of technical sciences, senior researcher, A.Z. MUKHARLYAMOVA, candidate of biological sciences, researcher, A.G. MUKHAMMETSHINA, junior researcher, A.M. SAIFUTDINOV, candidate of chemical sciences, leading researcher, laboratory of physical, chemical and precision analysis, Federal Center for Toxicological, Radiation and Biological Safety, e-mail: fizhimlab5@yandex.ru
The article presents the results of studies conducted to determine the content of residual amounts of two drugs of the 5-nitroimidazole group ‒ metronidazole and dimetridazole – commonly used in pig farming for the treatment and prevention of gastrointestinal diseases in pork samples sold to the population in the Republic of Tatarstan.
Metronidazole was detected in a number of pork samples. Additionally, using a screening method, trace amounts of dimetridazole were detected in one of the meat samples.
Key words: metronidazole, dimetridazole, pork, high-performance liquid chromatography, mass spectrometry.
Введение
Мясо и полуфабрикаты из свинины являются одним из основных наиболее доступных видов мясной продукции, а также источником полноценных животных белков и входящих в их состав незаменимых аминокислот, относительно легкоусвояемых жиров, витаминов, ценных макро- и микроэлементов [16, 18, 21]. Такая доступность этого вида мяса обусловлена в первую очередь биологическими особенностями свиней интенсивно набирать живую массу при низком расходе недорогих (преимущественно концентрированных сочных кормов и пищевых отходов) кормов, многоплодностью свиноматок и сравнительно высокой скороспелостью потомства ‒ от этапа молочного поросенка до этапа годной к забою взрослой особи, набравшей необходимый вес [9].
Для удовлетворения постоянно растущего потребительского спроса производство свинины приобрело промышленные масштабы [1, 17], что помимо увеличения рентабельности свиноводства как отрасли сельского хозяйства привело к обострению традиционных и возникновению новых проблем, связанных с однообразием и питательной неполноценностью кормовой базы, нарушением метаболизма и снижением иммунитета поголовья [2, 5, 7, 13].
Нарушение условий кормления и содержания свиней в хозяйствах способствует распространению гельминтозов [1] и желудочно-кишечных заболеваний, а недостаточно продуманный подход к профилактике приводит, в свою очередь, к развитию лекарственно-устойчивых штаммов возбудителей различных болезней и условно-патогенной микрофлоры и, как следствие, ‒ к снижению продуктивности и возрастанию рисков падежа молодняка [3].
Наиболее часто мероприятия по предотвращению развития и лечению болезней желудочно-кишечного тракта у свиней заключаются в проведении механической очистки и дезинфекции свинарников, применении эффективных растительных и синтетических химиотерапевтических препаратов энтерального пользования, а также различных лекарственных и профилактических антибактериальных и противопротозойных средств, в частности нитроимидазолов [4]. Это широкий класс ветеринарных препаратов, производных имидазола, имеющих терапевтическое применение для профилактики и лечения геморрагического энтерита, балантидиоза и дизентерии [8, 10‒12, 14, 15].
Основными действующими веществами таких препаратов являются метронидазол, диметридазол, ронидазол, ипронидазол, гидроксиипронидазол, гидроксиметронидазол, гидроксиметилметронидазол, тернидазол и тинидазол [6, 22‒25]. При этом наибольшее распространение в ветеринарной практике получили препараты, включающие в свой состав метронидазол и диметридазол (табл.).
Таблица. Краткая характеристика фармакологического действия метронидазола и диметридазола
|
Препарат |
Основные характеристики |
|
Метронидазол (2-(2-метил-5-нитро-1H-имидазол-1-ил)этанол; 1-(2-гидроксиэтил)-2-метил-5-нитроимидазол) |
Проявляет высокую активность по отношению к штаммам микроорганизмов Trichomonas vaginalis, Gardnerella vaginalis, Giardia intestinalis, Entamoeba histolytica, Lamblia intestinalis, Brachyspira hyodysenteriae, а также анаэробных грамотрицательных и грамположительных микроорганизмов – Bacteroides spp., Fusobacterium spp., Veillonella sрр., Prevotella, Clostridium spp., Peptostreptococcus spp., Eubacterium, Peptococcus spp. [10] |
|
Диметридазол (1,2-диметил-5-нитро-1Н-имидазол; 1,2-диметил-5-нитроимидазол) |
Активен в отношении простейших (Balantidium, Histomonas, Trichomonas) и анаэробных бактерий (Campylobacter, Bacteroides, Serpulina), в промышленном свиноводстве также применяется с лечебной и лечебно-профилактической целью при дизентерии свиней, вызываемой микроорганизмами Brachyspira hyodysenteriae [14] |
Согласно техническим регламентам Таможенного союза ТР ТС 021/2011 и ТР ТС 034/2013, безопасность мяса, мясных продуктов и полуфабрикатов определяется наличием или отсутствием в них запрещенных, вредных или опасных для здоровья человека веществ и химических соединений, в том числе антибиотиков и других антибактериальных препаратов [19, 20]. При этом наличие остаточных количеств метронидазола и диметридазола в свинине и содержащих свинину мясных продуктах, которые могут присутствовать в мясе при слишком раннем забое, после прекращения применения данных ветеринарных препаратов не допускается и требует строгого контроля.
В лабораторию физико-химического и прецизионного анализа ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности» на исследование поступили образцы свинины для контроля содержания в них метронидазола.
Цель исследования ‒ определение содержания метронидазола и диметридазола в представленных образцах свинины хроматографическими методами.
Материалы и методы
В качестве объектов исследований послужили 15 образцов охлажденной вырезки из промышленной свинины, произведенной крупными свиноводческими предприятиями Республики Татарстан, а также пять образцов вырезки из обычной деревенской свинины, выращенной в сельской местности в домашних условиях в частных хозяйствах.
Исследования выполнены методами высокоэффективной жидкостной хроматографии (ВЭЖХ) на жидкостном хроматографе марки Agilent 1100 с ультрафиолетовым (УФ) и масс-спектрометрическим (МС) детекторами. Для разделения в режиме элюирования подвижной фазы применялись колонки Luna 100 С18 5µ (250×4,6 мм) с размером частиц сорбента 5 мкм и Dionex Acclaim RSLC 120 C18 2,2µ (100×2,1 мм) с размером частиц сорбента 2,2 мкм.
Для приготовления растворов элюента мобильной фазы, стандартных и градуировочных растворов анализируемых соединений, а также в качестве растворителей-экстрагентов использовались следующие реактивы: аналитический стандарт метронидазола с содержанием основного вещества 99,6%, аналитический стандарт диметридазола с содержанием основного вещества 98,0%, метанол (для ВЭЖХ), ацетонитрил (для ВЭЖХ) и бидистиллированная вода, картриджи для твердофазной экстракции Oasis HLB (объем ‒ 12 см3, размер диаметра частиц ‒ 30 мкм).
Пробоподготовка осуществлялась по методике, за основу которой была взята схема, описанная в ГОСТе 54904-2012 [6].
Результаты и обсуждение
Метронидазол в организме свиней распределяется в большинстве тканей, при этом его содержание преобладает в мышцах, а также в печени и почках. Следовательно, при осуществлении контроля за остаточным количеством метронидазола необходимо проводить исследование именно этих тканей.
Идентификацию проводили по времени удерживания (tR) метронидазола в хроматографической колонке (tR = 7,9 мин.) (рис. 1а). Определение содержания осуществляли по градуировочной зависимости. По результатам проведенного нами хроматографического анализа в девяти образцах промышленного мяса был обнаружен метронидазол, содержание которого в среднем не превышало 100 мкг на 1 кг мяса.
По степени воздействия на организм метронидазол относится к умеренно опасным веществам и в рекомендуемых ветеринарами дозах хорошо переносится сельскохозяйственными животными, не проявляет эмбриотоксические, тератогенные и гепатотоксические свойства.
Известно, что терапевтическая концентрация метронидазола и его активных метаболитов (гидроксильного и ацетатного) сохраняется в организме на протяжении 8‒12 часов, время выведения при однократном применении составляет двое-трое суток, а при проведении курса профилактики или лечения может достигать четырех-пяти дней. В связи с этим убой сельскохозяйственных животных на мясо разрешается не ранее, чем через пять суток после последнего применения метронидазола [8].
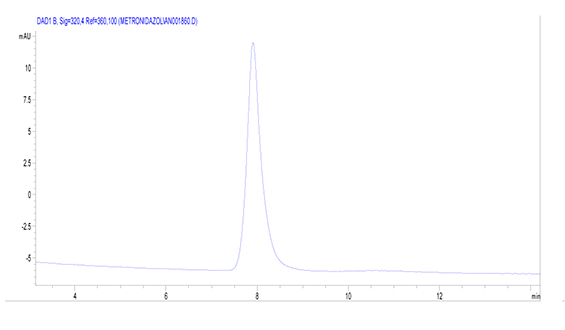
а
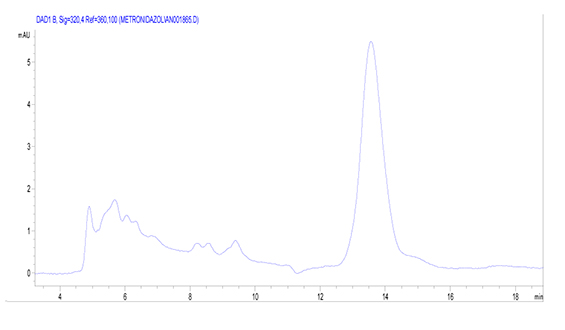
б
Рис. 1. Хроматограмма стандартного раствора метронидазола (а) и одного из экстрактов образца вырезки свинины с содержанием диметридазола (б)
Следует отметить, что на хроматограмме одного образца свинины присутствовал неидентифицированный пик (tR = 13,5 мин.) (рис. 1б). Предположительно, неизвестное соединение относится к классу 5-нитроимидазолов из-за поглощения в области 320 нм, что характерно для данного класса веществ.
Для более детального анализа и исключения наличия других представителей группы нитроимидазолов были проведены исследования с применением масс-спектрометрии высокого разрешения. Результаты исследования подтвердили наличие метронидазола, выявленного методом ВЭЖХ-УФ в девяти образцах.
Метронидазол идентифицировали по псевдомолекулярному протонированному иону [M+H]+ с измеренным m/z = 172,0721 Да (расчетное m/z = 172,0717 Да). Для подтверждения содержания метронидазола использовали осколочный ион [M+H-C2H4O]+ с измеренным m/z = 128,0458 Да (расчетное m/z = 128,0455 Да).
Также выполняли поиск его основного метаболита – гидроксиметронидазола. Для его идентификации использовали псевдомолекулярный протонированный ион [M+H]+ с измеренным m/z = 188,0671 Да (расчетное m/z = 188,0666 Да). Для подтверждения содержания гидроксиметронидазола использовали осколочный ион [M+H-C2H6O2]+ с измеренным m/z = 126,0302 Да (расчетное m/z = 126,0298 Да).
В ходе скринингового исследования в одном из образцов свинины, содержащем метронидазол, также были выявлены следовые количества диметридазола. Для его идентификации использовали псевдомолекулярный протонированный ион [M+H]+ с измеренным m/z = 142,0615 Да (расчетное m/z = 142,0611 Да). Для подтверждения применяли осколочный ион [M+H-NO2]+ с измеренным m/z = 96,0686 Да (расчетное m/z = 96,0682 Да). Основной метаболит диметридазола – гидроксидиметридазол идентифицировали по псевдомолекулярному протонированному иону [M+H]+ с измеренным m/z = 158,0563 Да (расчетное m/z = 158,0560 Да).
Для подтверждения наличия гидроксидиметридазола использовали осколочный ион [M-OH]+ с измеренным m/z = 126,0459 Да (расчетное m/z = 140,0455 Да). Таким образом, скрининговым методом удалось установить, что неидентифицированный пик на хроматограмме (при анализе ВЭЖХ-УФ) соответствует диметридазолу.
Следует учесть, что диметридазол токсичен, при этом некоторые исследования продемонстрировали мутагенные свойства самого диметридазола и его метаболитов. В настоящее время это вещество относят к вероятным канцерогенам.
Диметридазол достигает максимальной концентрации в крови через один-два часа после применения, при этом продолжительность действия после однократного приема составляет 18‒24 часа, при длительном курсе приема возможна кумуляция. Убой животных на мясо разрешается не ранее, чем через девять суток после прекращения использования лекарственного средства.
Наличие метронидазола и диметридазола в образцах промышленного мяса может быть обусловлено нарушением сроков выжидания после прекращения применения данных лекарственных средств до забоя животных на мясо.
В оставшихся шести образцах промышленной свинины по результатам исследований определяемые нитроимидазолы полностью отсутствовали или их содержание не превышало предел чувствительности метода анализа.
При проверке образцов деревенского мяса остаточных количеств как диметридазола, так и метронидазола обнаружено не было, что, скорее всего, связано с отсутствием применения данных ветеринарных препаратов в малых хозяйствах в условиях малочисленности поголовья свиней или с соблюдением предубойной выдержки животных в соответствии с установленными правилами.
Заключение
Таким образом, в результате проведенных исследований установлено, что в проверенных образцах деревенского мяса свинины остаточные количества данных нитроимидазолов обнаружены не были. Из 15 образцов свинины, произведенной на крупных свиноводческих предприятиях и в фермерских хозяйствах Республики Татарстан, в восьми образцах мяса был выявлен метронидазол и в одном образце – метронидазол и диметридазол, что указывает на наличие нарушений правил убоя свиней на мясо после применения ветеринарных препаратов на некоторых исследуемых предприятиях.
Литература
- Беспалова Н.С., Тамбовцев Д.В. Региональные особенности эпизоотологии кишечных нематодозов свиней в Липецкой области. Ветеринарный врач, 2024. №2. С. 59‒63.
- Бочкарев А.К., Ермолова Е.М. Эффективность применения сорбентов в свиноводстве. Известия Оренбургского государственного аграрного университета, 2018. №6(74). С. 249‒251.
- Буханов В.Д., Везенцев А.И., Зуев Н.П., Козубова Л.А., Воловичева Н.А. Комбинированные препараты для лечения дизентерии у свиней. Региональные геосистемы, 2012. №3(122). Вып. 18. С. 174‒179.
- Буханов В.Д., Везенцев А.И., Шапошников А.А., Скворцов В.Н., Зуев Н.П., Козубова Л.А., Воловичева Н.А., Фролов Г.В. Применение фитоаскорбоминералосорбента при колибактериозе телят и дизентерии свиней. Региональные геосистемы, 2010. №9(80). Вып. 11. С. 99–103.
- Гладких Л.П., Семенов В.Г., Софронов В.Г., Никитин Д.А. Иммунопрофилактика ‒ перспективный прием интенсификации свиноводства. Ученые записки КГАВМ имени Н.Э. Баумана, 2017. №3. С. 28‒33.
- ГОСТ 54904-2012. Продукты пищевые, продовольственное сырье. Метод определения остаточного содержания сульфаниламидов, нитроимидазолов, пенициллинов, амфениколов с помощью высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектором. М.: Стандартинформ, 2013. 20 с.
- Задорова Н.Н. Особенности проявления ритмичности роста у свиней. Вестник Ульяновской государственной сельскохозяйственной академии, 2016. №1. С. 85‒88.
- Инструкция по применению препарата ветеринарного «Метронидазол 20% БТ». Животноводство КРС. URL: http://www.zivotnovodstvo.ru/wp-content/uploads/2014/05/metronidazol20.pdf.
- Косенко Т.Г. Ведение эффективного свиноводства. Вопросы науки и образования, 2019. №21(68). С. 74‒76.
- Машковский М.Д. Лекарственные средства. М: Новая Волна, 2012. 1216 с.
- Мухарлямова А.З., Балымова М.В., Мухамметшина А.Г., Сайфутдинов А.М., Гайнуллин А.З. Определение антибиотиков тетрациклиновой группы методом ВЭЖХ-МС/МС. Бутлеровские сообщения, 2022. Т. 70. №6. С. 48‒54.
- Мухарлямова А.З., Мингалеев Д.Н., Сайфутдинов А.М., Шлямина О.В. Оценка долгосрочной стабильности антибиотиков тетрациклиновой группы хромато-масс-спектрометрическим методом. Ветеринарный врач, 2023. №5. С. 15‒20.
- Мухарлямова А.З., Тремасова А.М. Ветеринарно-санитарная экспертиза мяса поросят при афлатоксикозе и на фоне лечения. Актуальные вопросы совершенствования технологии производства и переработки продукции сельского хозяйства, 2020. №22. С. 474‒476.
- Наставление по применению «Диметридазола 45%» при дизентерии у свиней. Портал промышленного скотоводства. URL: https://www.korovainfo.ru/upload/iblock/12a/Dimetridazol%2045.pdf?ysclid=m1aoc290uo292005703.
- Аковбян В.А. Практическое руководство по антиинфекционной химиотерапии/В.А. Аковбян, А.С. Андреева, И.В. Андреева и др. Смоленск: Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии, 2007. 462 с.
- Семенов С.В. Проведение ветеринарных профилактических мероприятий в свиноводстве. Сельскохозяйственные науки и агропромышленный комплекс на рубеже веков, 2013. №4. С. 183‒186.
- Смирнова В.В., Смирнова М.Ф. Развитие свиноводства в условиях интенсификации отрасли. Известия Санкт-Петербургского государственного аграрного университета, 2016. №42. С. 240‒247.
- Татулов Ю.В., Коломиец Н.Н., Грикшас С.А., Петров Г.А. Сравнительная характеристика мясной продуктивности некоторых отечественных и зарубежных генотипов свиней. Промышленное и племенное свиноводство, 2008. №7. С. 16‒20.
- Технический регламент Таможенного союза ТР ТС 021/2011 «О безопасности пищевой продукции» от 9 декабря 2011 года №880. https://urfu.ru/fileadmin/user_upload/common_files/docs_units/oseb/TR_TS_021-2011_Tekhnicheskii_reglament_Tamozhennogo_sojuza_O_bezopasnosti_pishchevoi_produkcii.pdf.
- Технический регламент Таможенного союза ТР ТС 034/2013 «О безопасности мяса и мясной продукции» от 9 октября 2013 года №68. https://agropit.ru/files/2024/04/ТР-ТС-0342013-Технический-регламент-Таможенного-союза-О-безопасности-мяса-и-мясной-продукции-с._Текст.pdf.
- Титова Е.В. Свиноводству – интенсивное приоритетное развитие. Актуальные вопросы экономических наук, 2009. №4‒3. С. 255‒258.
- Shen J., Yhang Y., Zhang S., Ding S. Determination of nitroimidazoles and their metabolites in swine tissues by liquid chromatography. Journal of AOAC International, 2003. №86(3). P. 505‒509.
- Zeleny R., Harbeck S., Schimmel H. Validation of a liquid chromatography-tandem mass spectrometry method for the identification and quantification of 5-nitroimidazole drugs and their corresponding hydroxy metabolites in lyophilised pork meat. Journal of Chromatography A, 2009. №1216(2). P. 249–256. DOI: 10.1016/j.chroma.2008.11.061.
- Granja R.H., Nino A.M., Reche K.V., Giannotti F.M., de Lima A.C., Wanschel A.C., Salerno A.G. Determination and confirmation of metronidazole, dimetridazole, ronidazole and their metabolites in bovine muscle by LC-MS/MS. Food Addit. & Contam. ‒ Part A: Chem., Anal., Control, Exposure & Risk Assess., 2013. 30(6). P. 970‒976. DOI: 10.1080/19440049.2013.787653.
- Sams M.J., Strutt P.R., Barnes K.A., Damant A.P., Rose M.D. Determination of dimetridazole, ronidazole and their common metabolite in poultry muscle and eggs by high performance liquid chromatography with UV detection and confirmatory analysis by atmospheric pressure chemical ionisation mass spectrometry. Analyst, 1998. №123(12). P. 2545‒2549. DOI: 10.1039/a805204b.