В 2025 году журналу
ИСПОЛНИТСЯ
95 ЛЕТ!
ЧИТАЙТЕ
Материалы к юбилею >>>

РУБРИКИ
 Племенное дело |
 Крупный план |
 Актуально |
 Корма |
 Техническая политика |
 Событие |
 Ветеринария |
 Эксклюзивное интервью |
 Статистика |
 Выставки |
Творчество
наших читателей
ЧИТАЙТЕ
Автор С.И. КАЛИНИЧЕНКО
ГИМН СВИНЬЕ >>>
СТАТЬИ ИЗ НОМЕРА
DOI: 10.37925/0039-713X-2020-6-57-61
УДК 616:619
К ВОПРОСУ СОВЕРШЕНСТВОВАНИЯ ТЕХНОЛОГИЙ ДИАГНОСТИКИ ТРИХИНЕЛЛЕЗА У СВИНЕЙ
Л.А. НАПИСАНОВА1, кандидат биолог. наук, ст. научный сотрудник, лаборатория паразитарных зоонозов, О.Б. ЖДАНОВА 1,2, доктор биолог. наук, ст. научный сотрудник, лаборатория иммунологии и молекулярных исследований, А.В. УСПЕНСКИЙ1, доктор вет. наук, профессор, член-корреспондент РАН, зав. лабораторией паразитарных зоонозов, А.К. МАРТУСЕВИЧ3, доктор биолог. наук, Е.С. КЛЮКИНА 4, ст. преподаватель, 1ВНИИП – филиал ФГБНУ ФНЦ ВИЭВ РАН, 2ФГБОУ ВО «Кировский ГМУ» Министерства здравоохранения РФ (Киров), 3Ф ГБОУ ВО «Нижегородская ГСХА», 4ГБОУ ВО «Московский государственный медицинский университет» Министерства здравоохранения РФ
Трихинеллез является одним из самых опасных гельминтозоонозов. Свиньи как источник инвазии играют ведущую роль в возникновении заболевания у человека. Задача данной работы заключалась в оценке основных технологий диагностики у домашних свиней с использованием компрессорной трихинеллоскопии и пептолиза (ткани мышц животных в искусственном желудочном соке), иммунологических и кристаллографических реакций. Методы компрессорной трихинеллоскопии и пептолиза, применяемые для постмортальной диагностики трихинеллеза, достаточно надежны, позволяют обнаружить источники инфекции и предотвратить развитие гельминтозооноза у человека. Практическое использование методов иммунологической диагностики, экспертиза мяса и мясных продуктов дают возможность предупреждать заражение человека опасным зоонозом.
Ключевые слова: Trichinella spiralis, компрессорная трихинеллоскопия, пептолиз, иммунологические и кристаллографические методы.
To the question of improving diagnostic technologies for pig Trichinosis
NAPISANOVA1, candidate of biological sciences, senior researcher, laboratory of parasitic zoonoses, O.B. ZHDANOVA1,2, doctor of biological sciences, senior researcher, laboratory of immunology and molecular research, professor, A.V. USPENSKY1, doctor of veterinary sciences, professor, corresponding member of RAS, head of the laboratory of parasitic zoonoses, A.K. MARTUSEVICH3, doctor of biological sciences,professor, E.S. KLYUKINA4, senior lecturer, 1VNIIP ‒ branch of FGBNU FSC VIEV RAS, 2 Kirov State Medical University, 3Nizhny Novgorod State Agricultural Academy, , 4Moscow State Medical University of the Ministry of Health of the Russian Federation
Trichinellosis is one of the most dangerous zoonosis. Pigs as a source of infection play the leading role in human infection. The task of present work is diagnosis of larvae at helminthozoonosis in domestic pigs using method of immunological and crystallografical reactions. Methods of compressor trichinelloscopy and peptolysis (muscle tissue of animals by applying artificial gastric juice) can be used for postmortal-diagnostics of Trichinellosis and is aimed at detection of sources of infection and prevention of helminth zoonosis in human. Moreover, this expertise should be conducted using a complex methods: compressor trichinelloscopy and peptolysis, immunological and crystallografical methods and PCR, because this methods contains the description and differentiation of larvae. Practical application of immunological diagnostics and other expertise of pigs, meat and meat products of pigs allows to prevent infection of human with dangerous zoonosis.
Key words: Trichinella spiralis, compressor trichinelloscopy, peptolysis, immunological and crystallografical methods.
Трихинеллез, один из опаснейших зоонозов, до сих пор наносит огромный ущерб свинофермам и предприятиям общественного питания. Возбудитель болезни Trichinell spiralis открыт Owen в 1835 году. Заболевание характеризуется хроническим течением с лихорадкой и аллергическими реакциями. Цикл развития проходит в организме свиньи полностью: кишечный трихинеллез сменяется мышечным. Инкапсулирование личинок начинается с третьей по девятую неделю после заражения [5, 29‒31]. Мясо зараженных свиней становится опасным для человека, лишь промораживание при низких температурах позволяет уничтожить личинки (-90ºС через 15 часов) [9, 10, 24]. Однако заболеваемость трихинеллезом по-прежнему регистрируется в Алтайском, Забайкальском, Красноярском, Приморском, Хабаровском краях, Ханты-Мансийском автономном округе, Иркутской и других областях. При этом удельный вес свинины в структуре факторов передачи инвазии составляет 42%. Согласно законодательству РФ мясо зараженных свиней утилизируется. Возможность употребления других продуктов свиноводства регламентируется положениям нормативных документов РФ (СанПиН-3.2.32.15-14, письмо Роспотребнадзора от 25 сентября 2017 года «О заболеваемости паразитозами, передающимися через мясо»): шпик перетапливается при температуре 100ºС, также может использоваться внутренний жир и шкуры после зачистки от остатков мяса. Применяются следующие методы диагностики трихинеллеза: компрессорная трихинеллоскопия и исследование перевариванием в искусственном желудочном соке, которые с 1923 года являются обязательными [16, 22, 23, 25, 26, 32]. Учитывая огромный экономический ущерб в хозяйствах, наносимый трихинеллезом, совершенствование прижизненной диагностики этого заболевания у свиней становится приоритетной задачей современной паразитологии.
Практически все существующие иммунологические тесты пытались использовать для диагностики трихинеллеза у свиней. Одной из первых реакций, примененных для диагностики трихинеллеза в России, была реакция кольцепреципитации (М.И. Романович, 1912). Позднее похожие реакции, основанные на феномене преципитации, испытали В.А. Калюс (1947, 1952), В.П. Пашук (1956, 1957) и другие, но все они отличались низкой эффективностью. Аллергические реакции (внутрикожная реакция (ВАР); Augustine, Taylor, 1932) не получили достаточного распространения из-за ложноположительных результатов. Более эффективными оказались реакции агглютинации. Например, достаточно чувствительным методом была реакция непрямой гемагглютинации, впервые примененная для диагностики трихинеллеза в 1956 году в США (Price, Weiner). Данная реакция до сих пор используется во многих странах для диагностики трихинеллеза человека и свиней. Агглютинационные реакции кармина, латекса и бентонита для диагностики трихинеллеза изучены А.В. Успенским в сравнении с реакциями агглютинации, реакцией непрямой гемагглютинации, и кольцепреципитации в капилляре (1971‒1974), при этом были испытаны различные антигены. Наиболее высокой диагностической эффективностью обладала реакция латексагглютинации (РЛА) [22, 23]. Существенным недостатком вышеуказанных методов диагностики трихинеллеза являлась субъективность учета результатов реакций и затрудненность в их документировании. Поэтому на протяжении всех последующих лет изучается возможность совершенствования диагностических технологий на основе иммуноферментной реакции (ИФР) [7, 8, 15‒19, 23‒25, 32]. Основатели метода Engval, Perlman предложили сокращенно называть метод ELISA (Enzyme linked immunosorbent assay). В России чаще этот тест называют иммуноферментный анализ (ИФА).
Преимуществом ИФА является высокая чувствительность и то, что для ее постановки в условиях свинокомплекса не требуется специального оборудования. В иммунодиагностике трихинеллеза методом ИФА достигнуты значительные успехи благодаря последним достижениям в таких областях, как культивирование паразитов in vitro, внедрение новых методов получения и очистки иммунодиагностических реагентов, использование моноклональных антител и разработка сверхчувствительного оборудования для иммуноанализа. Однако в начальной стадии заболевания или при его легкой форме уровень антител может быть ниже предела чувствительности обнаружения, что порождает ложные отрицательные ответы. И наоборот, в некоторых случаях специфические антитела сохраняются в кровотоке в течение нескольких лет после выздоровления, из-за чего могут быть получены ложные положительные ответы. Поэтому в настоящее время рассматриваются и другие методы диагностики, дополнительные к основной методике тесты.
Такая высокочувствительная методика, как ПЦР, выявляющая характерные для генома T.spiralis локусы ДНК, основана на взаимодействии синтезированных олигонуклеотидных праймеров со специфичными для данного генотипа паразита локусами ДНК. В итоге даже при минимальных количествах антигена (имеющегося в организме) происходит рост амплифицируемого фрагмента в ходе реакции, присущего для этого генотипа.
Данный метод дорогостоящий и требует наличия хорошо оснащенных лабораторий с подготовленным персоналом, что при использовании на перерабатывающих свинину предприятиях будет снижать рентабельность производства. Поэтому в настоящее время при массовых эпидемиологических и эпизоотических исследованиях на трихинеллез обычно пользуются вариантом ИФР, направленным на поиск антител, как наиболее практичным (Varela-Dias et al., 1977; Cuesta et al., 1982; В.К. Бережко с соавт., 1987, 1996‒2005; Л.А. Написанова, 1994‒2003, 2005; С.Н. Белозеров, 1990, 1997; О.Б. Жданова, 2008; О.Г. Полетаева, 1997‒2003).
Начиная с 2007 года были предприняты первые попытки внедрения кристаллографических методов исследования биологических субстратов при трихинеллезе [3, 4, 17, 20, 21, 26‒29]. Различные тест-методики для идентификации патологических состояний организма человека и животных с использованием мочи и сыворотки крови, в том числе кристаллографические реакции, достаточно широко применяются в клинической диагностической практике.
Наибольшей чувствительностью и значительным спектром диагностируемых заболеваний обладают методы, рассматривающие сыворотку крови в качестве объекта изучения (О.П. Алексеева, А.В. Воробьев, 2003, А.К. Мартусевич, 2013). Учитывая вышесказанное, была предпринята попытка разработки экспресс-методики, которую можно применить в качестве первичного и (или) вспомогательного теста при диагностике трихинеллеза у свиней. Причем необходимыми требованиями при его выборе явились достаточная точность и возможность широкого использования без вложения значительных материальных средств [1, 2, 11‒15].
Цель исследования заключалась в испытании ИФА в сочетании с кристаллографическим анализом сыворотки крови свиней для диагностики трихинеллеза.
Материалы и методы
Для исследования применяли метод непрямого твердофазного ИФА с использованием белкового фракционированного антигена, абсорбированного в лунках микропанелей. Выделенные личинки от лабораторных крыс накапливали до необходимого объема, замораживая и сохраняя при температуре -20°С, для приготовления фракций соматического экстракта. Получение соматического фракционированного антигена личинок Т.spiralis проводили фракционированием цельного экстракта личинок трихинелл по модифицированной методике Magat (1976) гель-хроматографией на колонке размером 2,2x70 см и объемом 220 см3. Антигенную активность полученных белковых фракций определяли в ИФР с использованием референс-положительных и отрицательных контрольных сывороток. Дополнительно по результатам реакции выделяли фракцию с высокими диагностическими свойствами.
В качестве испытуемого биологического материала были использованы пробы сыворотки крови и мясного сока, взятые у домашних свиней из различных областей РФ из банка сывороток ВИГИС. Постановку ИФА, учет и интерпретацию полученных результатов осуществляли по классической методике. Учет реакции при визуальной оценке проводили, сравнивая степень окраски испытуемых сывороток с контрольными, а при автоматической ‒ на спектрофотометре при длине волны 492 нм. Положительной считали сыворотку, превосходящую по оптической плотности отрицательный контроль на 0,080 и более единиц. Диагностическая эффективность ИФР при трихинеллезе свиней с соматическим фракционированным антигеном рассчитывали традиционным способом, для которого использовали 123 сыворотки крови свиней, в том числе и от экспериментально зараженных Т.spiralis и Echinococcus granulosus, естественно инвазированных Cysticercus tenuicollis (5) и Oesophagostomum dentatum (2), клинически здоровых (90). Для подтверждения диагноза применяли метод переваривания мышц в искусственном желудочном соке.
Все исследования методом ИФА у клинически здоровых свиней, направленные на выявление антител, сопровождались послеубойной микроскопией по обнаружению личинок трихинелл в мясе. Помимо ИФА в целях составления диагностического алгоритма также проведена оценка результатов собственного и инициированного кристаллогенеза сыворотки крови здоровых свиней и свиней, зараженных Trichinella spiralis (доза возбудителя – 1 тыс. личинок). Для этого на 30-й день после заражения производили получение биожидкости и исследовали ее способом кристаллоскопии по методу Мартусевича с соавт. (2013) [11‒15].
Результаты и обсуждение
Известно, что специфичность ИФА напрямую связана с типом и количеством антигена трихинелл, используемого для адсорбции. При экспериментальном трихинеллезе свиней в ИФА с фракционированным антигеном наблюдали только положительные результаты теста, хотя в каждой группе фиксировали значительные колебания интенсивности инвазии (ИИ) и результатов ИФА. По окончании опыта экспериментально зараженные личинками Т.spiralis свиньи были забиты и методом переваривания проб мышц в искусственном желудочном соке была определена интенсивность инвазии. У шести поросят в 1 г мышечной ткани (ножки диафрагмы) выявили 4,1, 0,5, 15,45, 9,75, 168,95 и 19,6 личинок трихинелл соответственно. Таким образом, количество личинок Т.spiralis в 1 г мышц коррелировало с дозой заражения: первая группа (1 тыс. личинок) ‒ 6,68, вторая группа (20 тыс. личинок) ‒ 66,1 личинки.
В первой группе антитела в минимальных диагностических титрах (ИФР 1:100) у поросенка №1 регистрировали с 25-го дня. В последующие сроки инвазии уровень антител увеличивался и достигал максимума с 80-го по 150-й день после заражения. У других животных из этой группы специфические антитела обнаруживали на 50-й и 40-й день инвазии, максимальные титры (1:800) ‒ с 90-го по 150-й день после заражения.
Во второй группе (заражение 20 тыс. личинок на животное) у поросенка №4 антитела к Т.spiralis регистрировали с 30-го дня инвазии с максимальным уровнем на 90‒120-й день. Похожая закономерность была отмечена в динамике антител у поросенка №5 с 20-го дня, у поросенка №6 ‒ с 20-го дня инвазии. Из этой группы период максимальных титров (1:12 800) наблюдался с 80-го по 150-й день. Ложноотрицательных ответов не наблюдали.
Специфичность реакции у всех животных с гетерологичной инвазией составила 97,46%. Ложноположительными были животные с эхинококкозом (2,54% случаев). У свиней, зараженных Е.granulosus, ложноположительный ответ при использовании соматических фракционированных антигенов обусловлен наличием общих для Т.spiralis и Е.granulosus антигенных детерминант.
Чувствительность составила как в группе естественно, так и в группе экспериментально зараженных животных 100%.
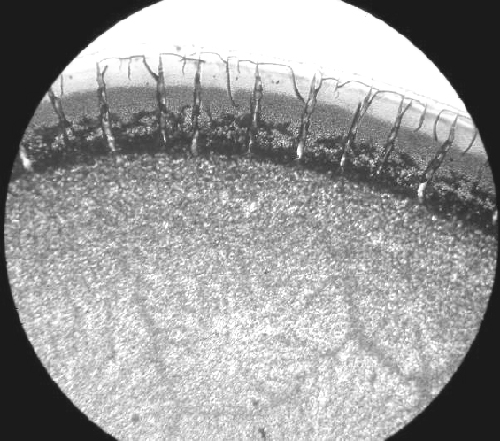
Рис. 1. Тезиграфия сыворотки здорового животного с 0,9%-ным раствором хлорида натрия

Рис. 2. Тезиграфическая фация сыворотки крови зараженных трихинеллезом свиней
Кроме использования морфологического подхода к интерпретации кристаллограмм рассматриваемой биосреды применялась система дополнительных критериев оценки, позволившая уточнить полученные при визуальной морфометрии данные.
Таблица. Диагностический кристаллоскопический паттерн сыворотки крови свиней при трихинеллезе
|
Параметр |
Диагностический диапазон |
|
Индекс структурности |
0‒0,5 |
|
Кристаллизуемость |
0‒0,5 |
|
Тип кристалло-аморфного взаимодействия |
Налипание |
|
Степень деструкции фации |
2‒2,5 |
|
Равномерность распределения элементов |
1,5‒2 |
|
Выраженность ячеистости |
2,5‒3 |
|
Выраженность зон фации |
1‒1,5 |
|
Четкость краевой зоны |
4‒4,5 |
|
Выраженность текстуры фации |
0,5‒1 |
Анализ собственной и инициированной кристаллизации сыворотки крови позволил верифицировать различия кристаллоскопических образцов у здоровых и зараженных трихинеллезом свиней, а также установить достаточный уровень критериев тезиокристаллоскопии биосреды для достижения чувствительности и специфичности теста более 75%. Полученную совокупность значений и сами образцы сопоставляли с составленными на основании проведенного ранее исследования картинами собственной и инициированной кристаллизации и тезиокристаллоскопическим паттерном (таблица). При совпадении с паттерном не менее шести значений параметров тезиокристаллоскопии фиксировали наличие трихинеллеза. В итоге для всех сывороток от зараженных животных кристаллоскопический паттерн соответствовал трихинеллезу. В то же время даже при экспресс–анализе фаций при первичной визуальной оценке у инвазированных трихинеллами свиней фация сыворотки крови резко отличается от фаций здоровых животных (рис. 1, 2).
Таким образом, уровень кристаллогенной активности биосреды (кристаллостаз) является видоспецифичным параметром ее гомеостаза, детерминированным особенностями, функциями и компонентным составом биологической жидкости. Характер данного эффекта определяется свойствами самого паразита и микроокружением (in vivo – метаболическим статусом организма-хозяина), и эти изменения могут стать диагностическими критериями при исследовании сыворотки. Однако отсутствие возможности его механизации и ограниченные возможности компьютеризации документации, а также трудоемкость в настоящее время позволяют его рекомендовать только для первичного исследования животных с дальнейшим исследованием в ИФА (И.П. Антропова, Я.Л. Габинский, 1997; А.К. Мартусевич, О.Б. Жданова, 2013) [17‒19].
Заключение
В результате опытов разработан алгоритм исследования сыворотки крови свиней на трихинеллез. С помощью специальных методических подходов был подобран протокол, позволяющий обеспечить минимальный уровень фонового окрашивания. Полученные нами результаты вполне согласуются с результатами зарубежных авторов, показавших высокую эффективность ИФА при проведении мониторинговых исследований на трихинеллез в странах Европы и Азии [3, 11‒13, 26, 30, 33]. Но стоит отметить, что согласно рекомендациям OIE, положительный результат различных серологических тестов не может считаться окончательным и должен быть обязательно подтвержден прямым обнаружением нематод в мясе [6, 14, 16]. Однако прижизненная диагностика трихинеллеза постоянно совершенствуется и одним из последних предложенных методов исследований стал кристаллографический анализ, который может быть применен в качестве просеивающего теста на трихинеллез в ИФА [6, 10‒15]. Основным методом диагностики остается ИФА, обладающий высокой чувствительностью и специфичностью и может использоваться для обследования свиней и подтверждения благополучия поголовья по трихинеллезу. ПЦР как дорогостоящий метод применяют в животноводстве в основном с целью более точного установления источника трихинелл и инвазирования животных их личинками.
Литература
- Алексеева О.П., Воробьев А.В. Кристаллография слюны – новый неинвазивный метод диагностики Нижегородский медицинский журнал, 2003. №2. С. 73‒78.
- Антропова И.П., Габинский Я.Л. Кристаллизация биожидкости в закрытой ячейке на примере слюны. Клиническая лабораторная диагностика, 1997. №8. С. 36‒38.
- Белозеров С.Н. Диагностика трихинеллеза свиней методом радиоактивных антител (РРА)//Материалы III Всесоюзной конференции по проблемам трихинеллеза человека и животных. Вильнюс, 1981. С. 144‒146.
- Белозеров С.Н., Жданова О.Б. Прижизненная диагностика трихинеллеза песцов с помощью иммуноферментной реакции. Ветеринария, 2000. №2. С. 34.
- Бессонов А.С. Виды и вариететы в роде Trichinella railliet//Материалы VIII Научной конференции по проблемам трихинеллеза человека и животных. М., 2000. С. 1‒16.
- Бережко В.К., Написанова Л.А., Успенский А.В., Шеховцов Н.В. Сравнительные испытания наборов на основе иммуноферментной реакции для прижизненной диагностики трихинеллеза//Материалы VII Научной конференции по трихинеллезу человека и животных. Всероссийский институт гельминтологии имени К.И. Скрябина, Институт медицинской паразитологии и тропической медицины имени Е.И. Марциновского, 1996. С. 7‒10.
- Жданова О.Б., Ашихмин С.П., Клюкина Е.С., Парамонова А.Н., Мутошвили Л.Р. Новые методологические решения в патоморфологии гельминтозов. Российский паразитологический журнал, 2010. №4. С. 74‒82.
- Жданова О.Б. Паразитозы плотоядных (патогенез, иммуноморфология и диагностика): Автореферат дисссертации доктора биолог. наук. М.: Всероссийский научно-исследовательский институт гельминтологии имени К.И. Скрябина, 2007.
- Жданова О.Б., Распутин П.Г., Масленникова О.В. Трихинеллез плотоядных и биобезопасность окружающей среды. Экология человека, 2008. №1. С. 9‒11.
- Жданова О.Б., Ашихмин С.П., Окулова И.И., Бельтюкова З.Н. Распространенность T.spiralis и некоторые особенности профилактики трихинеллеза в Кировской области. Здоровье населения и среда обитания, 2017. №1(286). С. 46‒49.
- Мартусевич А.К., Жданова О.Б., Янченко В.А. Патогенетическое значение изучения кристаллообразования биологических жидкостей при альвеококкозе. Анналы хирургической гепатологии, 2006. Т. 11. №3. С. 50‒51.
- Мартусевич А.К., Ашихмин С.П., Симонова Ж.Г., Жданова О.Б. Изучение феномена микроорганизм-паразит-ассоциированного кристаллогенеза в модельных условиях. Здоровье населения и среда обитания, 2013. №1. С. 42‒44.
- Мартусевич А.К., Жданова О.Б. Исследование зависимости кристаллогенной активности биосреды от интенсивности инвазии Trichinella spiralis. Российский паразитологический журнал, 2013. №2. С. 64‒71.
- Мартусевич А.K., Жданова О.Б. Информативность исследования свободного кристаллообразования при зоонозах на модели лабораторных животных. Поволжский регион: Известия высших учебных заведений, 2006. №1(22). С. 30‒39.
- Мартусевич А.К., Жданова О.Б., Написанова Л.А., Ашихмин С.П. Применение dot-ELISA и биокристаллоскопии для прижизненной диагностики трихинеллеза. Российский иммунологический журнал, 2013. Т. 7. №2‒3. С. 187.
- Методические указания по лабораторной диагностике трихинеллеза животных от 28 октября 1998 года. №13-7-2/1428.
- Написанова Л.А. Сравнительное изучение диагностической эффективности модифицированного экскреторно-секреторного антигена трихинелл//Материалы VIII Научной конференции по проблемам трихинеллеза человека и животных. М., 2000. С. 128‒130.
- Написанова Л.А., Бережко В.К., Сивкова Т.Н. Эффективность точечной иммуноферментной реакции (дот-ИФА) в диагностике трихинеллеза и эхинококкоза. Вятский медицинский вестник, 2015. №4(48). С. 18‒21.
- Написанова Л.А., Жданова О.Б., Мартусевич А.К., Ашихмин С.П., Клюкина Е.С. Спектрофотометрические исследования кристаллогенных свойств сыворотки крови различных половозрастных групп свиней в норме и при трихинеллезе. Теория и практика борьбы с паразитарными болезнями, 2012. №13. С. 271‒273.
- Одоевская И.М., Бенедиктов И.И., Асеев В.В., Хилюта Н.В. Методика идентификации Trichinella spiralis методом ПЦР. Российский паразитологический журнал, 2014. №3. С.147‒150.
- Полетаева О., Угликова М., Хюбнер И., Красовская Н. Эффективность двух тест-систем иммуноферментного анализа в диагностике трихинеллеза человека. Медицинская паразитологии и паразитарные болезни, 1990. №4. С. 43‒45.
- Успенский А.В. Изучение реакции латексагглютинации для прижизненной диагностики трихинеллеза животных. М.: Бюллетень ВИГИС, 1971. Вып. 5. С. 127‒130.
- Успенский А.В. Диагностическая эффективность агглютинационных реакций при спонтанном трихинеллезе песцов. М.: Бюллетень ВИГИС, 1974. Вып. 12. С. 88‒90.
- Успенский А.В. Некоторые особенности распространения трихинеллеза в России//Материалы VIII Научной конференции по проблемам трихинеллеза человека и животных. М., 2000. С. 68‒72.
- Успенский А.В., Скворцова Ф.А. Метод ветеринарно-санитарной экспертизы мяса промысловых животных при паразитарных зоонозах. Российский паразитологический журнал, 2014. №3. С. 151‒157.
- Cui J., Wang Z.Q. An epidemiological overview of swine Trichinellosis in China. Vet. J., 2011. Vol.190. 3:323‒328.
- Gamble H.R., Pozio E., Bruschi F. et al. International commission on Trichinellosis: Recommendations on the use of serological tests for the detection of Trichinella infection in animals and human. Parasite, 2004. Vol. 11. P. 3‒13.
- Ruitenberg E.J., van Knapen F., Vermeulen C.J. Enzyme-linked immunosorbent assay (ELISA) in Trichinella spiralis infections in pigs//Proc. of the 4-th Int. Conf. on Trichinellosis. Poznan, 1978. P. 487‒489.
- Rudneva O.V., Napisanova L.A., Zhdanova O.B., Berezhko V.K. Evaluation of the protective activity of different immunostimulatory drugs at the experimental trichinosis on white mice//International Journal of High Dilution Research. 2018. Т. 17. № 2. С. 17-18.
- Schuppers M.E., Rosenberg G., Graf R. et al. A study to demonstrate freedom from Trichinella spp. in domestic pigs in Switzerland. Zoonoses Public Health, 2010. Vol. 57. 7‒8:130‒135.
- Szell Z., Marucci G., Ludovisi A. et al. Spatial distribution of Trichinella britovi, T.spiralis and T.pseudospiralis of domestic pigs and wild boars (Sus scrofa) in Hungary. Vet. Parasitol., 2012. Vol. 183. 3‒4:393‒396.
- Zhdanova O.B., Haidarova A.A., Napisanova L.A., Rossohin D., Lozhenicina O. The possibility of using Trichinella spiralis as an experimental model in the field of high dilutions. International Journal of High Dilution Research, 2015. Vol. 14. №2. Р. 60‒61.
- World Organization of Animal Health (OIE). Trichinellosis. Manual of Standards for diagnostic test and vaccines, 2012. Ch.2.1.16.







