В 2025 году журналу
ИСПОЛНИТСЯ
95 ЛЕТ!
ЧИТАЙТЕ
Материалы к юбилею >>>

РУБРИКИ
 Племенное дело |
 Крупный план |
 Актуально |
 Корма |
 Техническая политика |
 Событие |
 Ветеринария |
 Эксклюзивное интервью |
 Статистика |
 Выставки |
Творчество
наших читателей
ЧИТАЙТЕ
Автор С.И. КАЛИНИЧЕНКО
ГИМН СВИНЬЕ >>>
СТАТЬИ ИЗ НОМЕРА
DOI:10.37925/0039-713Х-2022-2-29-33
УДК: 619:616.98:616.9-092.9:578.52:579.62
ДОКЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ СУБЪЕДИНИЧНОЙ МАРКИРОВАННОЙ ВАКЦИНЫ ПРОТИВ КЧС ПО ПОКАЗАТЕЛЯМ БЕЗВРЕДНОСТИ, АНТИГЕННОЙ АКТИВНОСТИ И ИММУНОГЕННОСТИ
Е.В. ШЕМЕЛЬКОВ1, кандидат вет. наук, e-mail: shemelkov@mail.ru, О.А. ВЕРХОВСКИЙ2, доктор биолог. наук, e-mail: verkhovsky@rosvet.ru, Т.И. АЛИПЕР1, доктор биолог. наук, e-mail: orgotdel@rosvet.ru, К.Ю. КУНАКОВ1, специалист отдела клинических исследований и мониторинга, e-mail: kkunakov@yandex.ru, К.П. АЛЕКСЕЕВ1, кандидат биолог. наук, e-mail: kkendwell@mail.ru, 1ООО «Ветбиохим», 2Научно-исследовательский институт диагностики и профилактики болезней человека и животных
Целью данной работы является оценка безвредности, антигенной и иммуногенной активности субъединичной маркированной вакцины против классической чумы свиней (КЧС), изготовленной из рекомбинантного белка Е2 вируса КЧС с добавлением масляного адъюванта нового поколения.
Проведенные исследования показали, что вакцина безопасна для выбранной модели животных и не вызывает местных и (или) общих нежелательных реакций при двукратном применении. Обладает выраженной антигенной активностью, индуцируя синтез поствакцинальных антител исключительно к белку Е2 вируса КЧС, что позволяет легко дифференцировать поствакцинальный и постинфекционный иммунный ответ. Разработанная вакцина обеспечила выживание всех вакцинированных поросят после контрольного заражения вирулентным штаммом вируса КЧС на фоне 100%-ной гибели животных в контрольной группе.
Ключевые слова: субъединичная маркированная вакцина, классическая чума свиней, белки Е2 и ЕRNS вируса КЧС, безвредность, антигенная и иммуногенная активность.
Preclinical studies of subunit marker vaccine against classical swine fever in terms of safety, antigenic activity and immunogenicity
E.V. SHEMELKOV1, candidate of veterinary sciences, e-mail: shemelkov@mail.ru, O.A. VERKHOVSKY2, doctor of biological sciences, e-mail: verkhovsky@rosvet.ru, T.I. ALIPER1, doctor of biological sciences, e-mail: orgotdel@rosvet.ru, K.Yu. KUNAKOV1, specialist of the department of clinical research and monitoring, e-mail: kkunakov@yandex.ru, K.P. ALEKSEEV1, candidate of biological sciences, e-mail: kkendwell@mail.ru, 1Vetbiohim LLC, 2Scientific Research Institute for Diagnostics and Prevention of Human and Animal Diseases
The purpose of the present study was to evaluate the innocuity, antigenic and immunogenic activity of a subunit marker vaccine against classical swine fever (CSF) prepared from recombinant CSFV protein E2 and containing new generation oil-based adjuvant.
The trials conducted demonstrated that the vaccine is innocuous in the animals selected as model and causes no local or systemic adverse reactions following double administration. The preparation’s antigenic activity is high, as it stimulates the production of post-vaccinal antibodies exclusively to the E2 protein of CSVF, which allows distinction between post-vaccination and post-infection immune response. The vaccine ensured the survival of all immunised piglets upon challenge with virulent CSFV, whereas all animals in the control group died.
Key words: subunit marker vaccine, classical swine fever virus, E2 and ERNS proteins of the CSF virus, vaccine safety, antigenic and immunogenic activity.
Введение
Классическая чума свиней остается одной из экономически значимых проблем для свиноводства, поскольку влечет за собой большие финансовые затраты на профилактику и ликвидацию последствий в случае возникновения вспышки болезни [1, 4, 14]. Одним из факторов экономических потерь от этой болезни является недополученная прибыль вследствие запрета экспорта продукции свиноводства на рынки многих стран из-за отсутствия у России в целом или отдельных ее регионов, в частности подтвержденного статуса свободных от вируса КЧС [2, 8, 9, 13, 14].
В настоящее время большинство развитых стран мира благодаря радикальным противоэпизоотическим мерам (эрадикации) благополучны по этой болезни и вакцинация против КЧС в них не проводится или запрещена. В нашей стране контроль за КЧС многие десятилетия осуществляется поголовной вакцинацией свиней живыми аттенуированными вакцинами на основе штаммов КС и ЛК-ВНИИВВиМ.
Тотальная вакцинация привела к многократному сокращению вспышек болезни и формированию в стране отдельных протяженных зон, свободных от КЧС. Однако на фоне постоянной циркуляции вакцинного вируса проблема КЧС остается перманентной. Несмотря на высокую практическую эффективность, использование живых вакцин против КЧС в большинстве случаев недопустимо по правилам импорта продуктов животного происхождения, кроме того, несет потенциальный риск рекомбинации вакцинного вируса с полевым.
Поэтому в качестве безопасной альтернативы живым вакцинам были разработаны субъединичные рекомбинантные вакцины на основе поверхностного гликопротеина Е2 вируса КЧС, которые имеют свои преимущества и недостатки, тем не менее они безопасны, обеспечивают защиту животных от контрольного заражения вирулентным вирусом и позволяют применять стратегию DIVА (Differentiating Infected From Vaccinated Animals ‒ дифференциация инфицированных от вакцинированных животных) [1, 3, 5, 6, 10‒12].
Ранее нами была разработана технология изготовления субъединичной маркированной вакцины на основе рекомбинантного белка Е2 вируса КЧС и масляного адъюванта, после применения которой у животных происходит синтез специфических антител к белку Е2 при полном отсутствии антител к другому гликопротеину вируса КЧС – ЕRNS. То есть эта вакцина обладает ярко выраженным маркером, позволяющим легко дифференцировать поствакцинальные и постинфекционные антитела методом ИФА [1, 7].
Материалы и методы
В качестве антигена использовали рекомбинантный поверхностный гликопротеин Е2 вируса КЧС, полученный в бакуловирусной системе экспрессии генов. Фрагмент гена, кодирующего использованный рекомбинантный белок Е2, был копирован с полевого изолята вируса КЧС штамма 8Z (генотип 1.1), который по своей генетической структуре близок к высоковирулентному штамму Ши-Мынь и отличается от последнего восемью заменами аминокислот.
В качестве адъюванта использовали смесь минерального и неминерального масла, которая позволяет готовить эмульсии типа «масло в воде». Характерной особенностью данного типа эмульсий является их низкая вязкость, что делает вакцинный препарат удобным в применении [7].
В качестве подопытной модели использовали поросят 50‒55-дневного возраста, не вакцинированных против КЧС и достигших серонегативного статуса к данному вирусу. Животные содержались в изолированном боксе №5 экспериментально-биологической лаборатории по работе с животными (виварный комплекс) ФГБУ «ВНИИЗЖ». Все поросята были персонализированы с помощью индивидуальных ушных бирок.
Подопытных поросят разделили на три группы по принципу аналогов:
‒ первая группа – вакцинированные животные (n=10, вакцинированные животные с последующим заражением);
‒ вторая группа – контактные животные (n=5, невакцинированные и незараженные животные);
‒ третья группа – контроль заражения (n=10, невакцинированные животные с последующим заражением).
Животные разных групп не были изолированы друг от друга.
Поросят первой группы иммунизировали экспериментальной маркированной вакциной против классической чумы свиней двукратно с интервалом три недели внутримышечно в дозе 2 см³ на голову. Животных второй и третьей группы не вакцинировали.
Через две недели после второй вакцинации животных первой и третьей группы заразили вирулентным штаммом Ши-Мынь вируса КЧС. Доза вируса КЧС для заражения составила более 1,02 lgЛД50/см³. Поросят второй группы не заражали.
Схема отбора крови и проведения других манипуляций с животными представлена в таблице 1.
Таблица 1. Схема манипуляций и отбора проб
|
Манипуляция |
Этап эксперимента |
|||||||||
|
до вакцинации |
21-е сутки после 1-й вакцинации |
14-е сутки после 2-й вакцинации |
сутки после заражения: |
|||||||
|
2-е |
5-е |
8-е |
11-е |
14-е |
17-е |
21-е |
||||
|
Взятие крови |
да |
да |
да |
нет |
да |
да |
да |
да |
да |
да |
|
Термометрия |
да |
через 4, 24, 48 и 72 часа |
ежедневно |
|||||||
|
Взвешивание |
да |
да |
да |
да |
да |
да |
да |
да |
да |
да |
Для выявления антител к белкам Е2 и ЕRNS вируса КЧС использовали соответствующие наборы ИФА согласно инструкции производителя:
‒ набор реагентов для определения антител к вирусу классической чумы свиней иммуноферментным методом «КЧС-СЕРОТЕСТ» (ООО «Ветбиохим», Россия);
‒ набор для выявления антител к белку ЕRNS вируса КЧС (PrioCHEK CSFV ERNS, Thermo Fisher Scientific, США).
Оценку безвредности экспериментальной вакцины проводили по следующим показателям:
‒ температура тела. Измеряли ректальную температуру тела животных до вакцинации, а также через 4, 24, 48 и 72 часа после каждого введения препарата;
‒ клиническое состояние животных. Вели наблюдение за общими реакциями организма животных на иммунизацию;
‒ оценка местной реакции на месте введения препарата. Ее осуществляли пальпацией и определением размера отека через 4, 24, 48 и 72 часа после каждого введения препарата.
Результаты исследований
Оценка безвредности экспериментальной вакцины показала следующее.
У поросят первой группы наблюдали кратковременное повышение температуры тела до 40,5°С после первого и второго введения вакцины. Температура тела приходила в норму на вторые сутки после каждой вакцинации.
У вакцинированных животных в течение 72 часов наблюдения не было отмечено какой-либо местной и (или) общей (за исключением повышения температуры тела) реакции организма как на первое, так и на повторное введение препарата в указанной дозе.
Выживаемость поросят среди вакцинированных животных была 100%-ной на 21-е сутки после заражения (срок окончания эксперимента), в то время как аналогичный показатель во второй и в третьей группе составил 60% и 0% соответственно (рис. 1).
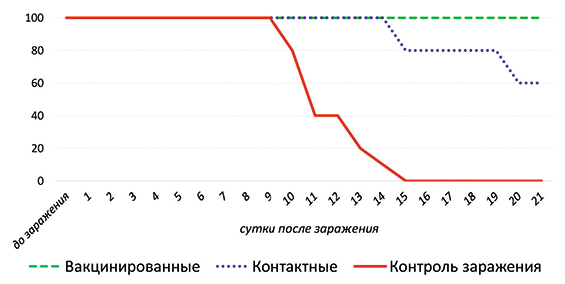
Рис. 1. Выживаемость поросят после заражения (%)
Оценка клинического состояния животных после заражения
В третьей группе первые клинические признаки заболевания (общее угнетение, вялость, малоподвижность) были зарегистрированы на третьи сутки после заражения. На четвертые-пятые сутки после заражения у поросят появился озноб, развилась анорексия. На шестые сутки начался профузный понос, у некоторых животных наблюдали рвоту с желчью. В дальнейшем на 10‒12-е сутки у поросят были отмечены конъюнктивиты с выделением слизисто-гнойного экссудата. Кожа пятачка, ушных раковин, живота, конечностей и хвоста приобрела синюшную окраску.
У отдельных животных преобладали клинические признаки поражения центральной нервной системы, включая эпилептические припадки. Перед гибелью поросята впадали в коматозное состояние, температура тела снижалась до 35‒36°С.
У поросят второй группы отмечали схожую клиническую картину, которая начала проявляться через 12‒15 суток после заражения поросят в первой и третьей группе. При этом к моменту окончания эксперимента двое из пяти поросят пали, прогноз по оставшимся животным был неблагоприятный ввиду нарастающей клинической картины развития заболевания.
У отдельных вакцинированных поросят первой группы в ответ на контрольное заражение вирусом КЧС замечали непродолжительное нарушение пищеварения (отсутствие аппетита, жидкий стул длительностью не более суток). На 21-е сутки наблюдения все поросята имели статус клинически здоровых животных.
У контрольных поросят (третья группа) наблюдали лихорадку с повышением температуры тела до 41,0‒41,7ºС в период с третьих по седьмые сутки после заражения вирусом КЧС (рис. 2). У вакцинированных животных (первая группа) лихорадка была менее выражена с повышением температуры тела до 40,5‒41,0ºС, которая была зафиксирована с четвертых по седьмые сутки после заражения.
В контактной группе животных (вторая группа) повышение температуры тела выше нормы (до 40,8‒41,3ºС) было зафиксировано в период с 15-х по 19-е сутки после заражения поросят первой и третьей группы.
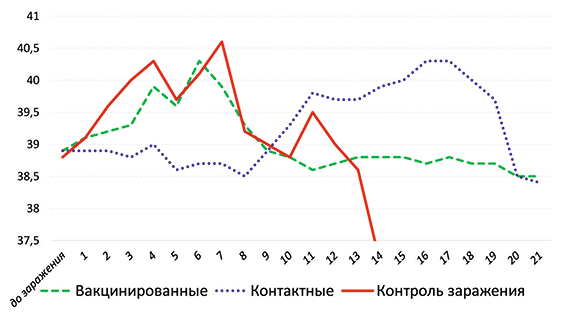
Рис. 2. Результаты термометрии поросят после заражения (среднее значение по группе)
Динамика набора живого веса поросятами
На протяжении всего исследования у вакцинированных поросят была установлена положительная динамика набора живого веса, за исключением периода с пятых по восьмые сутки после заражения. Среднесуточный прирост живой массы до заражения составлял 0,500 г, после заражения – 0,540 г, при этом в последнюю неделю наблюдения данный показатель достиг 0,730 г (табл. 2).
У контрольных животных было отмечено снижение массы тела начиная со вторых суток после заражения. Средняя потеря живого веса составила от 30,6 кг до 23,8 кг за первые 11 суток после заражения.
Во второй группе до 11 суток после заражения поросят в других группах фиксировали положительную динамику набора веса, а затем она сменилась на его потерю, которую наблюдали до конца эксперимента.
Таблица 2. Изменение живого веса поросят в течение опыта (кг)
|
Группа |
Живой вес поросят |
|||||||||
|
до вакцинации |
после 1-й вакцинации |
после 2-й вакцинации |
Сутки после заражения |
|||||||
|
2-е |
5-е |
8-е |
11-е |
14-е |
17-е |
21-е |
||||
|
1-я (вакцинированные) |
18,0 |
26,8 |
34,8 |
35,6 |
32,9 |
32,6 |
29,4 |
30,5 |
33,6 |
37,5 |
|
15,9 |
23,8 |
31,0 |
32,4 |
32,9 |
30,8 |
34,6 |
35,6 |
38,7 |
40,8 |
|
|
16,4 |
25,9 |
33,3 |
34,9 |
35,5 |
36,3 |
41,4 |
44,3 |
46,8 |
50,1 |
|
|
14,7 |
23,5 |
30,3 |
31,0 |
30,6 |
29,6 |
33,1 |
35,5 |
37,2 |
39,9 |
|
|
17,6 |
28,9 |
40,1 |
40,7 |
41,1 |
39,3 |
43,5 |
46,1 |
49,5 |
53,2 |
|
|
15,9 |
28,4 |
34,0 |
34,8 |
35,9 |
37,2 |
40,6 |
43,0 |
46,2 |
50,3 |
|
|
18,9 |
29,9 |
40,7 |
42,0 |
43,2 |
43,5 |
46,4 |
51,8 |
54,1 |
56,7 |
|
|
16,6 |
26,6 |
36,4 |
37,3 |
38,8 |
38,8 |
42,6 |
46,4 |
49,0 |
52,4 |
|
|
18,4 |
27,4 |
34,5 |
36,1 |
38,5 |
37,7 |
41,4 |
42,1 |
41,3 |
38,9 |
|
|
16,9 |
24,7 |
32,1 |
32,9 |
33,9 |
31,2 |
35,2 |
38,2 |
41,1 |
43,8 |
|
|
2-я (контактные) |
15,4 |
25,9 |
31,9 |
33,3 |
36,6 |
35,2 |
40,3 |
38,4 |
36,7 |
34,0 |
|
14,3 |
23,2 |
30,9 |
31,0 |
30,7 |
31,2 |
33,9 |
31,8 |
32,0 |
33,9 |
|
|
16,9 |
26,9 |
32,9 |
34,2 |
37,9 |
41,4 |
41,4 |
38,2 |
35,9 |
33,1 |
|
|
15,7 |
24,1 |
30,0 |
30,7 |
31,4 |
33,2 |
33,5 |
31,6 |
* |
* |
|
|
18,5 |
29,1 |
37,2 |
38,4 |
40,2 |
40,9 |
38,9 |
37,5 |
* |
* |
|
|
3-я (контроль заражения) |
14,2 |
21,7 |
29,6 |
29,8 |
26,3 |
25,1 |
* |
* |
* |
* |
|
16,1 |
24,6 |
31,4 |
31,0 |
28,5 |
25,9 |
* |
* |
* |
* |
|
|
15,9 |
24,8 |
30,6 |
29,7 |
26,4 |
25,5 |
* |
* |
* |
* |
|
|
15,8 |
23,4 |
29,7 |
29,6 |
28,5 |
26,8 |
26,5 |
* |
* |
* |
|
|
15,1 |
20,7 |
27,7 |
26,8 |
24,5 |
23,1 |
* |
* |
* |
* |
|
|
16,3 |
26,8 |
35,4 |
33,4 |
31,2 |
30,4 |
28,9 |
26,5 |
* |
* |
|
|
13,6 |
19,3 |
26,5 |
24,3 |
21,9 |
20,8 |
19,0 |
* |
* |
* |
|
|
15,4 |
22,4 |
28,9 |
27,4 |
25,9 |
23,4 |
22,1 |
* |
* |
* |
|
|
15,6 |
24,8 |
33,5 |
31,0 |
29,5 |
28,0 |
* |
* |
* |
* |
|
|
16,2 |
25,2 |
33,6 |
32,2 |
30,4 |
28,1 |
* |
* |
* |
* |
|
Оценка антигенной активности экспериментальной вакцины
На момент первой вакцинации все животные в первой и третьей группе имели серонегативный статус к вирусу КЧС. У двух поросят из пяти во второй группе результаты определения уровня антител к белку Е2 находились в серой зоне, то есть были сомнительные. Таким образом, можно говорить об отсутствии колострального иммунитета у животных, которые были подвергнуты вакцинации.
Через 21 сутки после первой вакцинации в первой группе 30% животных показали положительный или сомнительный результат при определении уровня антител к белку Е2 вируса КЧС. У поросят других групп данных антител обнаружено не было. При этом все подопытные поросята не имели антител к белку ЕRNS вируса КЧС.
Через 14 суток после второй вакцинации все вакцинированные поросята имели высокий уровень антител к белку Е2 вируса КЧС и не имели антител к белку ЕRNS, что свидетельствует о развитии специфического иммунного ответа исключительно на экспериментальную вакцину. Животные второй и третьей группы были серонегативны к обоим указанным белкам вируса КЧС (табл. 3).
Таблица 3. Количество животных с разным серологическим статусом в отношении белков Е2 и ЕRNS вируса КЧС по группам (гол.)
|
Группа |
Серологический статус животного |
Этап эксперимента |
|||||||||||
|
до вакцинации |
после 1-й вакцинации |
после 2-й вакцинации |
8-е сутки после к/з |
11-е сутки после к/з |
21-е сутки после к/з |
||||||||
|
Е2 |
ЕRNS |
Е2 |
ЕRNS |
Е2 |
ЕRNS |
Е2 |
ЕRNS |
Е2 |
ЕRNS |
Е2 |
ЕRNS |
||
|
1-я (вакцинированные) |
положительный |
0 |
0 |
3 |
0 |
10 |
0 |
10 |
1 |
10 |
7 |
10 |
9 |
|
сомнительный |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
отрицательный |
10 |
10 |
7 |
10 |
0 |
10 |
0 |
9 |
0 |
3 |
0 |
1 |
|
|
2-я (контактные) |
положительный |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
2 |
|
сомнительный |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
отрицательный |
2 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
1 |
1 |
|
|
3-я (контроль заражения) |
положительный |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
* |
* |
|
сомнительный |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
* |
* |
|
|
отрицательный |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
4 |
4 |
* |
* |
|
Примечание: к/з – контрольное заражение.
⃰⃰ на 5-е, 14-е и 17-е сутки после контрольного заражения значительных изменений в серологическом статусе животных отмечено не было.
На восьмые сутки после заражения у одного из вакцинированных поросят были обнаружены антитела к белку ЕRNS, на 11-е сутки таких поросят было уже семь. К окончанию эксперимента 9 из 10 вакцинированных поросят имели антитела к белку ЕRNS вируса КЧС, при этом все они имели антитела к белку Е2.
Заключение
В ходе проведенного исследования на серонегативных поросятах 50‒55-дневного возраста было установлено, что экспериментальная маркированная вакцина против классической чумы свиней является безвредным иммунобиологическим препаратом для животных указанной возрастной группы и не вызывает местных и (или) общих нежелательных поствакцинальных реакций после двукратного применения в рекомендуемых производителем дозах.
Испытанная вакцина обладает выраженными антигенными свойствами, обеспечивая высокий уровень поствакцинальных сывороточных антител к гликопротеину Е2 вируса классической чумы свиней после второй иммунизации поросят при полном отсутствии антител к гликопротеину ЕRNS вируса КЧС. Таким образом, применение данной вакцины позволяет легко дифференцировать поствакцинальные антитела от постинфекционных, что делает возможным ее использование для реализации стратегии DIVA по искоренению классической чумы свиней.
Экспериментальная маркированная вакцина обладает высокой иммуногенной активностью в отношении вируса КЧС, обеспечив в проведенном опыте 100%-ную защиту от заболеваемости и гибели вакцинированных животных после заражения вирулентным штаммом «Ши-Мынь» вируса КЧС на фоне 100%-ной гибели поросят контрольной группы.
Таким образом, результаты проведенных исследований можно рассматривать как важную фазу доклинический испытаний субъединичной маркированной вакцины на основе рекомбинантного белка Е2 вируса КЧС.
Литература
- Алексеев К.П., Раев С.А., Южаков А.Г., Шемельков Е.В., Латышев О.Е., Елисеева О.В., Костина Л.В., Цибезов В.В., Стаффорд В.В., Кунаков К.Ю., Верховский О.А., Забережный А.Д., Алипер Т.И. Разработка и испытание образцов рекомбинантной субъединичной вакцины против классической чумы свиней. Сельскохозяйственная биология, 2019. №54(6). С. 1236‒1246. DOI: 10.15389/agrobiology.2019.6.1236rus.
- Алипер Т.И., Алексеев К.П., Шемельков Е.В., Верховский О.А., Забережный А.Д. Перспектива использования маркированных вакцин против классической чумы свиней в Российской Федерации//Материалы Международной научно-практической конференции, посвященной 100-летию Армавирской биофабрики: Научные основы производства и обеспечения качества биологических препаратов. Армавир, 2021. С. 54‒60.
- Львов Д.К. Вирусы и вирусные инфекции человека и животных. М.: Медицинское информационное агентство, 2013. 1200 с.
- Непоклонов Е.А. Классическая чума свиней: разработка методов лабораторной диагностики и средств специфической профилактики: Автореферат диссертации доктора биолог. наук/Е.А. Непоклонов. М., 2000.
- Сергеев В.А., Непоклонов Е.А., Алипер Т.И. Вирусы и вирусные вакцины. М.: Библионика, 2007. 524 с.
- Сергеев В.А., Орлянкин Б.Г., Алексеев К.П., Забережный А.Д., Алипер Т.И., Непоклонов Е.А. Вакцины и стратегия вакцинации против классической чумы свиней. Ветеринария, 2018, №4. С. 3‒11.
- Шемельков Е.В., Верховский О.А., Алипер Т.И. Иммунитет при инфекционных болезнях: теория и прикладные аспекты//Руководство для студентов, научных и практических специалистов: Актуальные инфекционные болезни свиней. М.: ЗооВетКнига, 2019. С. 101‒127.
- Blome S., Mos C., Reimann I., König P., Beer M. Classical swine fever vaccines: State-of-the-art. Veterinary Microbiology, 2017. 206:10‒20. DOI: 10.1016/j.vetmic.2017.01.001.
- Chander V., Nandi S., Ravishankar C., Upmanyu V., Verma R. Classical swine fever in pigs: Recent developments and future perspectives. Animal Health Research Reviews, 2014. 15(1):87101. DOI: 10.1017/S1466252314000024.
- Dong X.N., Chen Y.H. Marker vaccine strategies and candidate CSFV marker vaccines. Vaccine, 2007. 25(2):205‒230. DOI: 10.1016/j.vaccine.2006.07.033.
- Madera R., Gong W., Wang L., Burakova Y., Lleellish K., Galliher-Beckley A., Nietfeld J., Henningson J., Jia K., Li P., Bai J., Schlup J., McVey S., Tu C., Shi J. Pigs immunized with a novel E2 subunit vaccine are protected from subgenotype heterologous classical swine fever virus challenge. BMC Veterinary Research, 2016. 12(1):197. DOI: 10.1186/s12917-016-0823-4.
- OIE Terrestrial Manual 2019. Chapter 3.8.3. https://www.oie.int/fileadmin/Home/eng/Health_standards/tahm/3.08.03_CSF.pdf.
- Wang F.I., Deng M.C., Huang Y.L., Chang C.Y. Structures and functions of pestivirus glycoproteins: Not simply surface matters. Viruses, 2015. 7(7):3506‒3529. DOI: 10.3390/v7072783.
- Zhou B. Classical swine fever in China: An update minireview. Frontiers in Veterinary Science, 2019. 6:187. DOI: 10.3389/fvets.2019.00187.








