В 2025 году журналу
ИСПОЛНИТСЯ
95 ЛЕТ!
ЧИТАЙТЕ
Материалы к юбилею >>>

РУБРИКИ
 Племенное дело |
 Крупный план |
 Актуально |
 Корма |
 Техническая политика |
 Событие |
 Ветеринария |
 Эксклюзивное интервью |
 Статистика |
 Выставки |
Творчество
наших читателей
ЧИТАЙТЕ
Автор С.И. КАЛИНИЧЕНКО
ГИМН СВИНЬЕ >>>
СТАТЬИ ИЗ НОМЕРА
DOI: 10.37925/0039-713X-2023-1-25-29
УДК 636.4.033/636.02/637.661
ИЗМЕНЧИВОСТЬ БИОХИМИЧЕСКИХ ПОКАЗАТЕЛЕЙ КРОВИ СВИНЕЙ ПОРОДЫ ДЮРОК НА ОСНОВЕ МОДЕЛИ СМЕШАННОГО УРАВНЕНИЯ
А.Ф. КОНТЭ, кандидат с.-х. наук, научный сотрудник, e-mail: alexandrconte@ya.ru, А.А. БЕЛОУС, кандидат биолог. наук, ст. научный сотрудник, e-mail: belousa663@gmail.com, О.А. ВОРОНИНА, кандидат биолог. наук, ст. научный сотрудник, e-mail: voroninaok-senia@inbox.ru, Н.В. БОГОЛЮБОВА, доктор биолог. наук, вед. научный сотрудник, e-mail: 652202@mail.ru, С.Ю. ЗАЙЦЕВ, доктор биолог. наук, вед. научный сотрудник, e-mail: s.y.zaitsev@mail.ru, ФГБНУ ФИЦ ВИЖ имени Л.К. Эрнста
В статье представлены биохимические показатели крови свиней породы дюрок, полученные классическим подходом. Использовали результаты биохимического анализа крови 78 клинически здоровых хряков в возрасте пяти месяцев средней живой массой около 100 кг, проходящих тестовый откорм на автоматических кормовых станциях. Изучали основные биохимические показатели (креатинин, мочевина, аланинаминотрансфераза, аспартатаминотрансфераза, щелочная фосфатаза, холестерин, триглицериды, общий белок, альбумин, глюкоза, общий билирубин). Проводили расчет генетических и фенотипических корреляций с применением программ RENUMF90, REMLF90.
Ключевые слова: биохимические показатели крови, модель смешанного уравнения, дисперсионная модель, генетические и фенотипические корреляции, свиньи породы дюрок.
Variability of biochemical indicators of the blood of pigs of the Duroc breed on the basis of a mixed equation model
A.F. KONTE, candidate of agricultural sciences, researcher, e-mail: alexandrconte@ya.ru, A.A. BELOUS, candidate of biological sciences, senior researcher, e-mail: belousa663@gmail.com, O.A. VORONINA, candidate of biological sciences, senior researcher, e-mail: voroninaok-senia@inbox.ru, N.V. BOGOLYUBOVA, doctor of biological sciences, leading researcher, e-mail: 652202@mail.ru, S.Yu. ZAITSEV, doctor of biological sciences, leading researcher, e-mail: s.y.zaitsev@mail.ru, FIZ VIZh named after L.K. Ernst
Our article presents the biochemical parameters of the blood of Duroc pigs, obtained by the classical approach. We used the results of a biochemical blood test of 78 clinically healthy boars undergoing test fattening at automatic feed stations, at the age of 5 months, with an average live weight of about 100 kg. The main biochemical parameters (creatinine, urea, alanine aminotransferase, aspartate aminotransferase, alkaline phosphatase, cholesterol, triglycerides, total protein, albumin, glucose, total bilirubin) were studied and genetic and phenotypic correlations were calculated using the RENUMF90, REMLF90 programs.
Key words: blood biochemical parameters, mixed equation model, dispersion model, genetic and phenotypic correlations, Duroc pigs.
Введение
Успехи биохимии и молекулярной биологии показали сложность строения белковых молекул и их многочисленные свойства как внутри, так и вне живого организма. Большинство биологических функций жизнедеятельности выполняются белками или при их непосредственном участии. Некоторые белки осуществляют функции гормонов, контролирующих метаболические процессы, некоторые из них действуют как катализаторы биохимических реакций, а другие служат строительным материалом. Ряд белков крови образуют антитела, определяющие устойчивость организма к различным заболеваниям. Такие сложные белки, как нуклеопротеиды, входят в состав генов, несущих генетическую информацию.
Свиньи широко применяются в биомедицинских исследованиях из-за их физиологического и анатомического сходства с людьми [1] и считаются популярными и ценными животными-моделями для изучения таких заболеваний, как желудочно-кишечные, почечные и сердечно-сосудистые у людей [2, 3]. Такие свиньи служат донорами органов при ксенотрансплантации [4]. Однако бактерии и вирусы, переносимые ими, влияют на точность и надежность исследований и могут вызывать инфицирование реципиента при ксенотрансплантации [5]. Риск заражения можно снизить за счет улучшения характеристик животных и асептических методов. Чтобы удовлетворить растущий спрос на качество свиней в биомедицинских исследованиях, часто используют животных, свободных от специфических патогенов (SPF) [6].
Анализ гематологических и биохимических показателей у свиней является важной основой для биомедицинских исследований и ветеринарной клинической диагностики. Он не только помогает оценить состояние здоровья и наличие заболевания, но также дает ориентир для патологоанатомического и токсикологического исследования.
Обычно гематологические и биохимические референтные значения варьируются в зависимости от возраста, пола, питания, окружающей среды, оборудования для тестирования, реакции на стресс и многих других факторов [7].
Биохимические эталонные интервалы сыворотки (ИС) играют важную роль в оценке здоровья животных. Однако что касается сельскохозяйственных животных, то большинство ИС устанавливаются для взрослых особей. Как и в медицине, где педиатрические ИС легко доступны, в ветеринарии существует необходимость в надежных и специфических ИС для молодняка. Использование интервалов ИС для взрослых особей может быть неадекватным, поскольку у молодых животных другой метаболизм. Кроме того, они должны находиться под пристальным наблюдением из-за уязвимости для болезней, а их рацион может оказывать большее влияние на состояние здоровья по сравнению со взрослыми особями. Таким образом, многие публикации ИС по ветеринарии созданы для взрослых животных и могут вводить в заблуждение, а установление ИС для молодняка дает возможность для более адекватного подхода к различию здоровых и больных свиней [1‒3].
В свиноводстве обычно используется ранний отъем поросят с целью сокращения и улучшения продуктивного цикла свиноматки. Как правило, отлучение происходит в возрасте 21–28 дней и после отделения от свиноматки поросенка необходимо адаптировать к новому корму (по большей части твердому рациону). В отличие от естественного отъема, который происходит постепенно до 17-недельного возраста, ранний отъем может стать стрессом для поросят [4‒8]. Непосредственный период после отъема имеет решающее значение для здоровья молодняка, так как в этот момент они очень восприимчивы к желудочно-кишечным заболеваниям и инфекциям.
За последние 20 лет постепенно установилась неонатальная клиническая биохимия и биохимические ИС у поросят моложе месячного возраста, где было нескольких заметных биохимических изменений в зависимости от дней жизни [12, 13]. Тем не менее данные исследования имеют два основных недостатка. Во-первых, ИС были рассчитаны для небольших популяций (<35), и это не соответствует требованию непараметрического ИС. Как предлагается в Руководстве Института клинических и лабораторных стандартов (CLSI), непараметрический метод рекомендуется благодаря его простоте и надежности, таким образом, достаточное количество животных для создания ИС может быть более адекватным [14]. Во-вторых, многие ИС рассчитываются на основе отдельных экспериментов и, поскольку на нее могут влиять такие факторы, как диета, география, время года, пол и порода, то полученное значение может быть неприменимым в других условиях.
Интенсивность и направленность процессов метаболизма в организме животных во многом зависят также и от условий питания, содержания, интенсивности их выращивания и других факторов. Большой интерес представляют исследования по изучению особенностей обмена белков и липидов в связи с возрастом, генотипом свиней и интенсивностью их выращивания.
В связи с вышеизложенным можно сделать вывод, что особый интерес представляет знание динамики изменчивости биохимических параметров свиней.
Материалы и методы исследования
Исследования по изучению генетической изменчивости параметров биохимического статуса свиней были проведены на хрячках породы дюрок численностью 78 голов.
Расчет медианы произведен в соответствии с формулой 1:
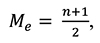 (1)
(1)
где n ‒ число признаков в совокупности.
Коэффициент асимметрии, характеризующий асимметрию распределения данной случайной величины, определен согласно уравнению 2:
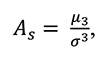 (2)
(2)
где μ3 = E [x – Ex3] – центральный момент третьего порядка величины x;
σ = D[x] = E [x – Ex2] – дисперсия, или центральный момент второго порядка величины x;
Коэффициент эксцесса распределения случайной величины x определяется согласно формуле 3:
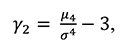 (3)
(3)
где μ4 = E [x – Ex4] – центральный момент четвертого порядка величины x;
σ = D[x] = E [x – Ex2] – дисперсия, или центральный момент второго порядка величины x; -3 введен для того, чтобы указывать отклонение стандартного нормального распределения.
Нами использовалось уравнение модели и процедура REML программы BLUPF90 для расчета показателей корреляций и варианс на основе единой базы исследуемых показателей.
Для вычисления значений генетических варианс и коварианс признаков применяли метод ограниченного максимального правдоподобия, согласно модели с использованием программ RENUMF90, REMLF90:
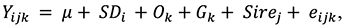 (4)
(4)
где: Yijk – оцениваемый показатель k-ого хрячка; μ – популяционная константа; SDi – фиксированный эффект i-го «станция-дата постановки»; Ok – возраст постановки на откорм k-ого животного; G – группа k-ого хрячка; Sirej – рандомизированный эффект j-го производителя (j=1, …, 16 гол.); eijk – эффект неучтенных факторов. Для определения силы влияния фиксированного эффекта «станция ‒ дата постановки» используем дисперсионный анализ.
Варианса представляет показатель, характеризующий изменчивость признака. Различают фенотипическую и генетическую вариансы.
Фенотипическая варианса ‒ степень варьирования проявления признака в определенных паратипических условиях. Отражает действие наследственности и среды на формирование величины признака и его изменчивость. Общая формула определения фенотипической вариансы:
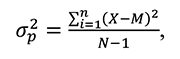
где: X — значение признака i-oй особи; М — среднее значение признака в популяции (выборке); N — число наблюдений.
Генетическая варианса ‒ часть общей фенотипической вариансы, обуславливающая изменчивость признака за счет генетических факторов. В ряде случаев называется аддитивной генетической вариансой. Связана соотношением с общей фенотипической вариансой: σg2 = h2 · σp2.
В общем виде фенотипическая и аддитивная генетическая вариансы могут быть связаны через средовую вариансу (σe2): σp2 = σg2 + σe2.
Результаты исследований и обсуждение
В ходе проведенного статистического анализа исследуемых биохимических показателей хрячков породы дюрок мы получили следующие результаты (табл. 1).
Таблица 1. Биохимические показатели крови хрячков породы дюрок
|
Показатель |
M̄ |
±m |
Mediana |
σ |
kurtosis |
As |
Min |
Max |
|
Общий белок, г/л |
75,0 |
0,81 |
75,3 |
7,5 |
3,29 |
0,18 |
50,9 |
105,3 |
|
Альбумин, г/л |
40,2 |
0,47 |
40,2 |
4,4 |
-0,31 |
-0,04 |
28,9 |
49,0 |
|
Глобулин, г/л |
34,9 |
0,70 |
33,9 |
6,5 |
1,63 |
0,57 |
16,2 |
56,3 |
|
А/Г |
1,2 |
0,03 |
1,2 |
0,3 |
1,97 |
0,83 |
0,7 |
2,1 |
|
Креатинин, мкМ/л |
103,5 |
2,27 |
105,5 |
21,0 |
0,20 |
-0,01 |
44,8 |
158,6 |
|
Глюкоза, мМ/л |
4,6 |
0,13 |
4,8 |
1,2 |
0,06 |
-0,39 |
1,1 |
7,0 |
|
Триглицериды, мМ/л |
0,5 |
0,03 |
0,3 |
0,3 |
-1,59 |
0,40 |
0,2 |
1,2 |
|
Холестерин, мМ/л |
2,4 |
0,04 |
2,4 |
0,4 |
0,60 |
0,34 |
1,5 |
3,7 |
|
АЛТ, МЕ/л |
29,2 |
0,84 |
28,6 |
7,8 |
0,79 |
0,70 |
12,5 |
55,3 |
|
АСТ, МЕ/л |
24,2 |
1,12 |
22,0 |
10,4 |
6,58 |
2,21 |
6,8 |
69,6 |
|
Коэффициент де Ритиса (АСТ/АЛТ) |
0,9 |
0,04 |
0,8 |
0,4 |
4,04 |
1,81 |
0,3 |
2,5 |
|
Щелочная фосфатаза, МЕ/л |
159,3 |
5,13 |
159,1 |
47,6 |
1,11 |
0,60 |
64,7 |
317,5 |
|
Ca, мМ/л |
2,6 |
0,03 |
2,6 |
0,3 |
1,16 |
-0,94 |
1,7 |
3,1 |
|
P, мМ/л |
3,5 |
0,07 |
3,5 |
0,6 |
11,19 |
2,39 |
2,4 |
6,8 |
|
Mg, мМ/л |
1,1 |
0,02 |
1,1 |
0,2 |
0,25 |
-0,08 |
0,5 |
1,5 |
Примечание: M̄ – среднее значение, ±m – ошибка среднего значения, Mediana ‒ серединное значение набора чисел (число, сумма расстояний (или, если более строго, модулей) от которого до всех чисел из набора минимальна), σ – стандартное отклонение, kurtosis – коэффициент эксцесса, As ‒ коэффициент асимметрии, Min – минимальное значение, Max – максимальное значение.
Исследуемые показатели крови хрячков находились в пределах допустимых норм. При этом щелочная фосфатаза и общий белок были наиболее близки к верхним границам допустимого оптимума. Что касается показателей, характеризующих изменчивость и сбалансированность данных выборки, то здесь не выявлено существенных отклонений. Медиана, представляющая серединное значение набора чисел, почти совпадает со средней статистической величиной. Коэффициент эксцесса, характеризующий степень остроты пика распределения случайной величины, был практически незначительно высокий по основной массе показателей, за исключением фосфора, аспартатаминотрансферазы (АСТ) и коэффициента де Ритиса (АСТ/АЛТ). Коэффициент асимметрии, или асимметрия, служит мерой несимметричности распределения. Если коэффициент значительно отличается от 0, распределение является асимметричным. Если значение его положительное, то в распределении в основном преобладают показатели, уступающие среднему арифметическому показателю. В этом случае асимметрия является положительной или левосторонней. В нашем же случае наиболее сильной и правосторонней асимметрией характеризуются те же показатели ‒ фосфор, АСТ и коэффициент де Ритиса.
Что касается уравнения смешанной модели, мы использовали дисперсионный анализ для определения влияния фиксированного эффекта «станция ‒ дата постановки» (табл. 2). В практике исследований по крупному рогатому скоту в уравнениях смешанной модели обычно применяют фиксированный фактор HYS («стадо ‒ год ‒ сезон отела»). В наших исследованиях объектом служили свиньи породы дюрок. Мы посчитали что фиксированным эффектом может быть выбран SD («станция ‒ дата постановки»). Для подтверждения правильности выбранного действия мы воспользовались дисперсионным анализом. Он наиболее полно характеризует тесноту взаимосвязи между факторами: станция, дата постановки на откорм и биохимическим составом крови, а также степень сопряженности – коэффициент детерминации (то есть силу влияния фактора).
Таблица 2. Результаты дисперсионного анализа влияния фактора «станция ‒ дата постановки»
|
Показатель |
Множест- R |
Множест- R2 |
Скорректи- R2 |
SS |
степень свободы |
MS |
SS |
степень свободы |
MS |
F |
p |
|
Общий белок, г/л |
0,58 |
0,33 |
0,18 |
1261,34 |
14 |
90,10 |
2526,9 |
63 |
40,11 |
2,25 |
0,02 |
|
Альбумин, г/л |
0,56 |
0,32 |
0,16 |
440,10 |
14 |
31,44 |
954,0 |
63 |
15,14 |
2,08 |
0,03 |
|
Глобулин, г/л |
0,49 |
0,24 |
0,08 |
624,22 |
14 |
44,59 |
1939,5 |
63 |
30,78 |
1,45 |
0,16 |
|
А/Г |
0,46 |
0,21 |
0,04 |
1,08 |
14 |
0,08 |
3,9 |
63 |
0,06 |
1,23 |
0,28 |
|
Креатинин, мкМ/л |
0,42 |
0,18 |
0,00 |
5988,37 |
14 |
427,74 |
27 515,2 |
63 |
436,75 |
0,98 |
0,48 |
|
Глюкоза, мМ/л |
0,67 |
0,45 |
0,33 |
43,93 |
14 |
3,14 |
53,4 |
63 |
0,85 |
3,70 |
0,00 |
|
Триглицериды, мМ/л |
0,98 |
0,97 |
0,96 |
7,76 |
14 |
0,55 |
0,2 |
63 |
0,00 |
142,29 |
0,00 |
|
Холестерин, мМ/л |
0,58 |
0,34 |
0,19 |
4,07 |
14 |
0,29 |
8,0 |
63 |
0,13 |
2,28 |
0,01 |
|
АЛТ, МЕ/л |
0,47 |
0,22 |
0,05 |
671,50 |
14 |
47,96 |
2392,9 |
63 |
37,98 |
1,26 |
0,26 |
|
АСТ, МЕ/л |
0,39 |
0,16 |
-0,03 |
3899,24 |
14 |
278,52 |
21097,7 |
63 |
334,88 |
0,83 |
0,63 |
|
Коэффициент де Ритиса (АСТ/АЛТ) |
0,42 |
0,17 |
-0,01 |
4,03 |
14 |
0,29 |
19,0 |
63 |
0,30 |
0,95 |
0,51 |
|
Щелочная фосфатаза, МЕ/л |
0,53 |
0,28 |
0,12 |
62775,22 |
14 |
4483,94 |
161 714,9 |
63 |
2566,9 |
1,75 |
0,07 |
|
Ca, мМ/л |
0,57 |
0,32 |
0,17 |
1,92 |
14 |
0,14 |
4,1 |
63 |
0,06 |
2,12 |
0,02 |
|
P, мМ/л |
0,64 |
0,41 |
0,27 |
4,05 |
14 |
0,29 |
5,9 |
63 |
0,09 |
3,07 |
0,00 |
|
Mg, мМ/л |
0,76 |
0,58 |
0,49 |
1,51 |
14 |
0,11 |
1,1 |
63 |
0,02 |
6,21 |
0,00 |
Примечание: полужирным шрифтом выделены показатели, на которые установлено достоверное влияние. Множественный R - множественный коэффициент корреляции характеризует тесноту связи между зависимой переменной и предиктором; Множественный R2 - коэффициент детерминации, показывает, какая доля дисперсии результативного признака объясняется влиянием независимых переменных; Скорректированный R2 - коэффициент детерминации, скорректированный на число факторов; SS - внутригрупповая изменчивость или дисперсия ошибки; MS - межгрупповой разброс (называемый средним квадратом эффекта); F критерий - оценивает статистическую значимость различия средних в группах; p - вероятность ошибочного результата.
Сопряженность влияния фактора SD «станция - дата постановки на откорм» показала, что между ними и рядом показателей биохимии крови существует достоверная положительная связь, согласно критерию Фишера (F). Достаточно высокий коэффициент детерминации (R2) свидетельствует о значительном влиянии SD на такие показатели, как общий белок, альбумин глюкозу, триглицериды, холестерин, Ca, P и Mg (рис. 1).
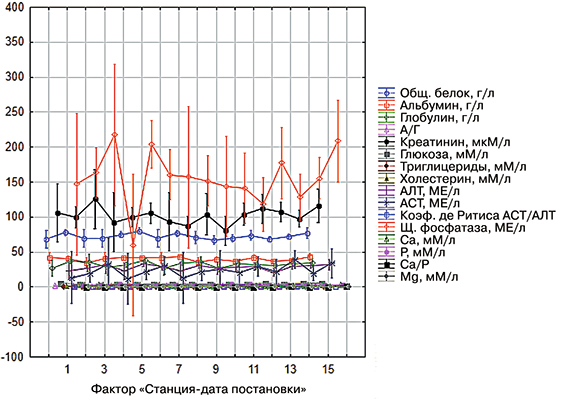
Рис. 1. Декомпозиция средних значений биохимических показателей в зависимости от фактора влияния
Влияние же фактора SD на такие показатели как глобулин, соотношение А/Г, креатинин, АЛТ, АСТ, коэффициент де Ритиса и щелочную фосфатазу было незначительным.
В результате проведенного расчета с применением уравнения смешанной модели на основе программной оболочки REMLF90 программы BLUPF90 мы получили фенотипические и генетические вариансы, характеризующие степень изменчивости показателей (табл. 3).
Таблица 3. Генетические и фенотипические вариансы показателей крови хрячков породы дюрок
|
Показатель |
σg2 |
σph2 |
|
Общий белок, г/л |
0,43 |
2,53 |
|
Альбумин, г/л |
0,85 |
3,35 |
|
Глобулин, г/л |
0,72 |
2,92 |
|
Креатинин, мкМ/л |
1,43 |
3,75 |
|
Глюкоза, мМ/л |
1,44 |
1,71 |
|
Триглицериды, мМ/л |
0,02 |
0,42 |
|
Холестерин, мМ/л |
2,34 |
3,15 |
|
АЛТ, МЕ/л |
1,21 |
3,82 |
|
АСТ, МЕ/л |
0,66 |
1,23 |
|
Коэффициент де Ритиса (АСТ/АЛТ) |
0,88 |
1,02 |
|
Щелочная фосфатаза, МЕ/л |
0,82 |
2,79 |
|
Ca, мМ/л |
1,14 |
2,94 |
|
P, мМ/л |
1,07 |
2,49 |
|
Mg, мМ/л |
0,28 |
1,66 |
Наибольшей изменчивостью характеризуются такие биохимические показатели, как холестерин, креатинин и глюкоза. При этом некоторые фенотипические вариансы в разы превосходят генетические.
Что касается генетических корреляций, то здесь установлены свои закономерности (рис. 2).
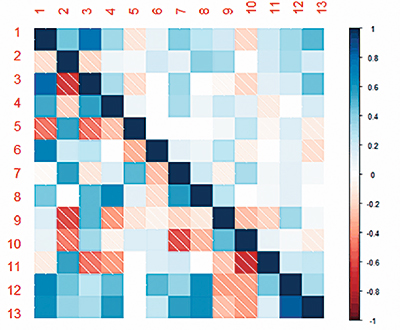
Рис. 2. Коррелограмма связей (генотипических и фенотипических) между показателями крови хрячков породы дюрок
Примечание: 1 ‒ общий белок, г/л; 2 ‒ альбумин, г/л; 3 ‒ глобулин, г/л; 4 ‒ креатинин, мкМ/л; 5 ‒ глюкоза, мМ/л; 6 ‒ триглицериды, мМ/л; 7 ‒ холестерин, мМ/л; 8 ‒ АЛТ, МЕ/л; 9 ‒ АСТ, МЕ/л; 10 ‒ щелочная фосфатаза, МЕ/л; 11 ‒ Ca, мМ/л; 12 ‒ P, мМ/л; 13 ‒ Mg, мМ/л.
*Ниже диагонали – генетические корреляции, выше – фенотипические корреляции.
Высокие значения установлены между общим белком и глобулином, триглицеридами, P и Mg. Альбумин коррелирует с глобулином, глюкозой и холестерином. В свою очередь холестерин имеет связь со щелочной фосфатазой. Креатинин взаимосвязан с АЛТ, а АЛТ ‒ с холестерином. Фосфор связан с магнием. Также следует обратить внимание на то, что генетические корреляции имеют значительный контраст с фенотипическими корреляциями.
Заключение
Таким образом, полученные результаты дают возможность сделать вывод о том, что кровь представляет собой лабильную буферную систему и ее показатели характеризуются достаточной изменчивостью. Уравнение смешанной модели, используемые в данном исследовании на свиньях породы дюрок, позволяет нам получить более глубокое представление о характере этой изменчивости. Для более полного и углубленного изучения и анализа изменчивости биохимических признаков на уровне биолого-математических экспериментов с уклоном в генетическую архитектуру, рекомендуется увеличить количество исследуемых проб.
Исследования по биохимическим параметрам крови свиней выполнены за счет гранта Российского научного фонда (проект №20-16-00032).
Литература
- Ji M.H., Yang J.J., Wu J. Experimental sepsis in pigs ‒ effects of vasopressin on renal, hepatic, and intestinal dysfunction. Ups. J. Med. Sci., 2012. 117:257–263.
- Aloi M., Tromba L., Nardo G.D. Premature subclinical atherosclerosis in pediatric inflammatory bowel disease. J. Pediatr., 2012. 161:589–594.
- Yang Y., Hayden M.R., Sowers S., Bagree S.V., Sowers J.R. Retinal redox stress and remodeling in cardiometabolic syndrome and diabetes. Oxid. Med. Cell. Longev., 2010. 3:392–403. Epub. 2010 Nov 1.
- Cooper D.K., Gollackner B., Sachs D.H. Will the pig solve the transplantation backlog? Annu. Rev. Med., 2002. 53:133–147.
- Chapman L.E., Folks T.M., Salomon D.R., Patterson A.P., Eggerman T.E., Noguchi P.D. Xenotransplantation and xenogeneic infections. N. Engl J. Med., 1995. 333:1498–1501.
- Safron J., Gonder J.C. The SPF pig in research. ILAR J., 1997. 38:28–31.
- Verheyen A.J., Maes D.G., Mateusen B. Serum biochemical reference values for gestating and lactating sows. Vet. J., 2007. 174:92–98. Epub. 2006 May 24.
- Kessell A. Bovine haematology and biochemistry. In: Bovine Medicine. Adelaide, SA: John Wiley & Sons, 2015. 159 p. DOI: 10.1002/9781118948538.
- Knowles T.G., Edwards J.E., Bazeley K.J., Brown S.N., Butterworth A., Warriss P.D. Changes in the blood biochemical and haematological profile of neonatal calves with age. Vet. Rec., 2000. 147:8‒593. DOI: 10.1136/vr.147.21.593.
- Baldwin R.L., McLeod K.R., Klotz J.L., Heitmann R.N. Rumen development, intestinal growth and hepatic metabolism in the pre- and postweaning ruminant. J. Dairy Sci., 2004. 87:E55–65. DOI: 10.3168/jds.S0022-0302(04)70061-2.
- Roy J.H.B., Huffman C.F., Reineke E.P. The basal metabolism of the newborn calf. Br. J. Nutr., 1957. 11:373. DOI: 10.1079/BJN19570058.
- Le Huerou I., Guilloteau P., Wicker C., Mouats A., Chayvialle J.A., Bernard C. Activity distribution of seven digestive enzymes along small intestine in calves during development and weaning. Dig. Dis. Sci., 1992. 37:6‒40. DOI: 10.1007/BF01308340.
- Jensen P. Maternal behaviour and mother young interactions during lactation in free-ranging domestic pigs. Appl. Anim. Behav. Sci., 1988. 20:297–308. DOI: 10.1016/0168-1591(88)90054-8.
- Egli C.P., Blum J.W. Clinical, haematological, metabolic and endocrine traits during the first three months of life of suckling simmentaler calves held in a cow-calf operation. Zentralbl Veterinarmed A., 1998. 45:99–118. DOI: 10.1111/j.1439-0442.1998.tb00806.x.
- Mohri M., Sharifi K., Eidi S. Hematology and serum biochemistry of Holstein dairy calves: Age related changes and comparison with blood composition in adults. Res. Vet. Sci., 2007. 83:9‒30. DOI: 10.1016/j.rvsc.2006.10.017.
- Pérez-Santos M., Castillo C., Hernández J., Abuelo Á. Biochemical variables from Holstein-Friesian calves older than one week are comparable to those obtained from adult animals of stable metabolic status on the same farm. Vet. Clin. Pathol., 2015. 44:51‒145. DOI: 10.1111/vcp.12218.
- Ventrella D., Dondi F., Barone F., Serafini F., Elmi A., Giunti M. The biomedical piglet: Establishing reference intervals for haematology and clinical chemistry parameters of two age groups with and without iron supplementation. BMC Vet. Res., 2017. 13:23. DOI: 10.1186/s12917-017-0946-2.
- Perri A.M., O'Sullivan T.L., Harding J.C.S., Wood R.D., Friendship R.M. Hematology and biochemistry reference intervals for Ontario commercial nursing pigs close to the time of weaning. Can. Vet. J., 2017. 58:6‒371.
- CLSI. Defining, Establishing, and Verifying Reference Intervals in the Clinical Laboratory. 3rd ed., 2010. Available online at: https://clsi.org/standards/products/method-evaluation/documents/ep28.







