В 2025 году журналу
ИСПОЛНИТСЯ
95 ЛЕТ!
ЧИТАЙТЕ
Материалы к юбилею >>>

РУБРИКИ
 Племенное дело |
 Крупный план |
 Актуально |
 Корма |
 Техническая политика |
 Событие |
 Ветеринария |
 Эксклюзивное интервью |
 Статистика |
 Выставки |
Творчество
наших читателей
ЧИТАЙТЕ
Автор С.И. КАЛИНИЧЕНКО
ГИМН СВИНЬЕ >>>
СТАТЬИ ИЗ НОМЕРА
DOI:10.37925/0039-713X-2023-6-44-47
УДК 619:616-091:636.4
ПАТОМОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ У ПОРОСЯТ ПРИ ТРИХОТЕЦЕНОВОМ МИКОТОКСИКОЗЕ
Т.П. МАКСИМОВ, кандидат вет. наук, директор по развитию бизнеса в Восточной Европе, e-mail: t.maksimov@mail.ru, ДСМ Нутришнл Продактс Россия, Кормление и Здоровье Животных, А.А. КУДРЯШОВ, доктор вет. наук, профессор, заведующий кафедрой патологической анатомии и судебной ветеринарной медицины, В.И. БАЛАБАНОВА, доктор вет. наук, профессор кафедры патологической анатомии и судебной ветеринарной медицины, e-mail: patan2017@outlook.com, ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»
Материалом исследования послужили 19 поросят-отъемышей в возрасте 52‒63 дней, у которых при жизни заподозрили микотоксикоз. Подвергли анализу также 10 проб полнорационного гранулированного комбикорма СК-4 для поросят в возрасте 1,5‒2 месяцев, скармливаемого в группах опытных животных.
Провели патологоанатомическое исследование, применив метод полной эвисцерации по Г.В. Шору. При вскрытии у поросят отобрали образцы печени и почек для гистологического исследования. Патологический материал фиксировали в 10%-ном растворе нейтрального формалина. Затем производили заливку в парафин и на ротационном микротоме изготовили срезы толщиной 5‒7 мкм. Срезы окрасили гематоксилином и эозином. Определили количественное содержание микотоксинов в пробах корма в лаборатории биохимического анализа Федерального научного центра «Всероссийский научно-исследовательский и технологический институт птицеводства» с использованием метода высокоэффективной хроматографии в тандеме с масс-спектрометрией (ВЖХ-МС/МС).
В ходе исследования в образцах комбикорма установлено содержание токсина T-2 в концентрации от 0,03 до 0,89 мг/кг и наличие токсина дезоксиниваленола (ДОН) в концентрации от 0,5 до 4,9 мг/кг, что значительно превышало предельно допустимые уровни этих микотоксинов в кормах для свиней. При вскрытии у поросят выявили кровоизлияния, очаги некроза и эрозии на коже, анемию, очаги некроза, эрозии, кровоизлияния, катаральное воспаление в желудке, кровоизлияния и воспаление в кишечнике, отек легких и острый реактивный гепатит. При гистологическом исследовании в печени обнаружили зернистую и водяночную дистрофию, некроз гепатоцитов, лейкоцитарную инфильтрацию пространств Диссе. В почках ‒ водяночную дистрофию и некроз клеток эпителия почечных каналец.
Ключевые слова: свиньи, патоморфологические изменения, дезоксиниваленол, токсин Т-2.
Pathomorphological changes in piglets at trichothecene mycotoxicosis
T.P. MAXIMOV, candidate of veterinary sciences, business development director Eastern Europe, e-mail: t.maksimov@mail.ru, DSM Nutritional Products Russia, Animal Nutritional & Health, A.A. KUDRIASHOV, doctor of veterinary sciences, professor, head of the department of pathological anatomy and forensic veterinary medicine, V.I. BALABANOVA, doctor of veterinary sciences, professor of the department of pathological anatomy and forensic veterinary medicine, e-mail: patan2017@outlook.com, St. Petersburg State University of Veterinary Medicine
The aim of the study was to identify pathomorphological changes in combined deoxynivalenol and T-2 toxicosis in piglets of the rearing group.
The material of the study was 19 weaned piglets aged 52‒63 days, in which mycotoxicosis was suspected during their lifetime. The material for the study also served as 10 samples of full-grain granular compound feed SK-4 for piglets aged 1.5‒2 months, fed in groups of the studied animals.
We conducted a pathoanatomic study using the method of complete evisceration according to G.V. Shor. During the autopsy, liver and kidney samples were taken from piglets for histological examination. The pathological material was fixed in a 10% solution of neutral formalin. Then the filling was carried out in paraffin and sections 5‒7 microns thick were made on a rotary microtome. The sections were stained with hematoxylin and eosin. The quantitative content of mycotoxins in feed samples was determined in the laboratory of biochemical analysis of the Federal Scientific Center All-Russian Scientific Research and Technological Institute of Poultry Farming using the method of high-performance chromatography in tandem with mass spectrometry (HPLC-MS/MS).
As a result of the study, the content of T-2 toxin in the concentration from 0.03 to 0.89 mg/kg and the presence of deoxynivalenol (DON) toxin in the concentration from 0.5 to 4.9 mg/kg were found in the feed samples, which significantly exceeded the maximum permissible levels of these mycotoxins in pig feed. At the autopsy, hemorrhages, foci of necrosis and erosion in the skin, anemia, foci of necrosis, erosion, hemorrhages, catarrhal inflammation in the stomach, hemorrhages and inflammation in the intestines, pulmonary edema and acute reactive hepatitis were found in piglets. Histological examination of the liver revealed granular and watery dystrophy, necrosis of hepatocytes, leukocyte infiltration of Disse spaces. In the kidneys - watery dystrophy and necrosis of the epithelial cells of the renal tubules.
Key words: pigs, pathomorphological changes, deoxynivalenol, T-2 toxin.
Введение
Наличие микотоксинов в кормах для продуктивных животных широко распространено на территории РФ, а их влияние на здоровье животных и человека подтверждено многочисленными исследованиями [8]. Многообразие микотоксинов, высокий уровень их токсичности, способность проникать в организм животных, накапливаться в органах, тканях и биологических жидкостях, оказывая отрицательное воздействие, вызывает большую озабоченность ветеринарных и зоотехнических специалистов хозяйств [4, 7]. Значительный экономический ущерб, причиняемый микотоксинами, складывается из затрат на ветеринарную обработку поголовья и снижения производственных показателей предприятий.
Микотоксины отличаются высокой токсичностью, многие из них обладают мутагенными, тератогенными, канцерогенными и иммуносупрессивными свойствами [1, 8]. Наиболее часто корма загрязняются микотоксинами грибов родов Fusarium и Aspergillus [5, 7].
На организм свиней оказывает негативное влияние большинство часто встречающихся микотоксинов: дезоксиниваленол (ДОН, вомитоксин), Т-2, HT-2, охратоксины, афлатоксины, фумонизины и др. [2, 11]. При наличии многочисленных научных работ по этиологии микотоксикозов, их распространению, лечебно-профилактическим мероприятиям в научной литературе в малом объеме и фрагментарно представлена патоморфология этих болезней.
Цель исследований
Учитывая значимость и актуальность микотоксикологической тематики в настоящее время, целью нашего исследования стало выявление патоморфологических изменений при сочетанном дезоксиниваленоловом и Т-2-токсикозе у поросят группы доращивания.
Материалы и методы
Объектом и материалом исследования послужили 19 поросят группы доращивания в возрасте 52‒63 дней, у которых при жизни заподозрили микотоксикоз. Материалом для анализа также послужили 10 проб полнорационного гранулированного комбикорма СК-4 для поросят на доращивании в возрасте 1,5‒2 месяцев, скармливаемого в группах опытных животных.
Провели патологоанатомическое исследование, применив метод полной эвисцерации по Г.В. Шору. У поросят при вскрытии отобрали образцы печени и почек для гистологического исследования. Гистологические срезы готовили по общепринятой методике. Патологический материал фиксировали в 10%-ном растворе нейтрального формалина. Затем производили заливку в парафин и на ротационном микротоме изготовили срезы толщиной 5‒7 мкм. Срезы окрасили гематоксилином и эозином. Изучение гистологических препаратов провели с помощью светооптического микроскопа «МИКМЕД-5» ЛОМО (Россия) при увеличении 400 и 600 крат. Микрофотографирование проводили посредством цифровой камеры ToupTek Photonic FMA050 (Китай).
Для количественного определения содержания микотоксинов в пробах корма, проведенного в лаборатории биохимического анализа Федерального научного центра «Всероссийский научно-исследовательский и технологический институт птицеводства», использовали метод высокоэффективной хроматографии в тандеме с масс-спектрометрией (ВЖХ-МС/МС). Для этого применяли комплекс оборудования из жидкостного хроматографа Agilent Infinity LC Systems (Германия) и тройного квадрупольного масс-спектрометра AB SCIEX Triple Quad™ 5500 (США) ГОСТ 34140-2017, оснащенного источником ионизации Turbo V, электроспреем (ESI) и вакуумным насосом.
Результаты исследования и обсуждение
Результаты микотоксикологического исследования
На основании данных протоколов проведенных исследований в лаборатории биохимического анализа ФНЦ ВНИТИП в образцах комбикорма СК-4 установлено содержание токсина T-2 в концентрации от 0,03 до 0,89 мг/кг. Наряду с этим в образцах выявлено наличие токсина дезоксиниваленола. Концентрация данного микотоксина варьировалась от 0,5 до 4,9 мг/кг. Таким образом, концентрация токсинов T-2 и дезоксиниваленола значительно превышала предельно допустимые уровни этих микотоксинов в кормах для свиней. Согласно ГОСТу 33867-2016 [3], «Максимально допустимым уровням микотоксинов в кормах для сельскохозяйственных животных» [6] и Техническому регламенту Таможенного союза, предельно допустимые уровни микотоксинов Т-2 (HT-2) и дезоксиниваленола составляют 0,1 и 1,0 мг/кг соответственно [9].
Клиническое проявление
У больных поросят наблюдали вялость, анорексию, задержку роста, диарею, рвоту, признаки анемии, у некоторых животных ‒ очаги некроза и эрозии на коже, а также мышечный тремор.
Результаты патологоанатомического исследования
При вскрытии поросят группы доращивания, получавших корм с концентрацией токсинов T-2 и дезоксиниваленола, превышавшей предельно допустимые уровни, установлены следующие патологоанатомические изменения. При наружном осмотре у поросят обнаружены кровоизлияния, очаги некроза и эрозии на коже (фото 1, 2) Также наблюдали признаки анемии – белый цвет кожи и видимых слизистых оболочек, что сочеталось с обнаруженной при внутреннем осмотре водянистой кровью (фото 3). При исследовании желудка у всех животных выявили патологоанатомические изменения в желудке и кишечнике: в желудке ‒ очаги некроза, эрозии, кровоизлияния в слизистой оболочке, катаральное воспаление (фото 4‒7); в кишечнике ‒ кровоизлияния и воспаление слизистой оболочки (фото 8, 9).
Подобные изменения считаются типичными для действия токсина Т-2 и его метаболитов [10]. В источниках научной информации констатируют, что токсин Т-2 обладает местнораздражающим свойством и вызывает серозно-геморрагическое воспаление, некроз и изъязвление в пищеварительном тракте, дистрофию печени, почек, сердца, головного мозга и периферических ганглиев вегетативной нервной системы [10]. Кроме того, он повреждает стенку кровеносных сосудов, провоцирует геморрагический диатез. Что касается непосредственно энтерита, то способность и ДОН изменять морфологию кишечника также известна. Этот микотоксин специфически воздействует на плотные соединения между энтероцитами, вызывая разрушение слизистой оболочки кишечника.
При внутреннем осмотре также диагностировали отек легких (фото 10) и острый реактивный гепатит (фото 11). Гепатит, равно как и энтерит, отмечают и при дезоксиниваленоловом токсикозе [12].
Результаты патогистологического исследования
В гистологических препаратах печени у поросят обнаружены изменения, свойственные острому реактивному гепатиту. Это зернистая водяночная дистрофия и некроз гепатоцитов, а также лейкоцитарная инфильтрация пространств Диссе (фото 12). В почках выявлены водяночная дистрофия и некроз (лизис) клеток эпителия почечных каналец (фото 13).
В целом можно заключить, что патоморфологические изменения при сочетанном дезоксиниваленоловом и Т-2-токсикозе у поросят группы доращивания согласуются с патоморфологическими изменениями, упомянутыми в источниках научной информации, при каждом из двух микотоксикозов.
Выводы
- При вскрытии поросят группы доращивания, получавших корм с концентрацией токсинов T-2 и дезоксиниваленола, превышавшей предельно допустимые уровни, обнаружены патологоанатомические изменения: кровоизлияния, очаги некроза и эрозии на коже; анемия, очаги некроза, эрозии, кровоизлияния, катаральное воспаление в желудке; кровоизлияния и воспаление в кишечнике; отек легких и острый реактивный гепатит.
- При патогистологическом исследовании в печени установили зернистую водяночную дистрофию и некроз гепатоцитов, а также лейкоцитарную инфильтрацию пространств Диссе, в почках ‒ водяночную дистрофию и некроз (лизис) клеток эпителия почечных каналец.
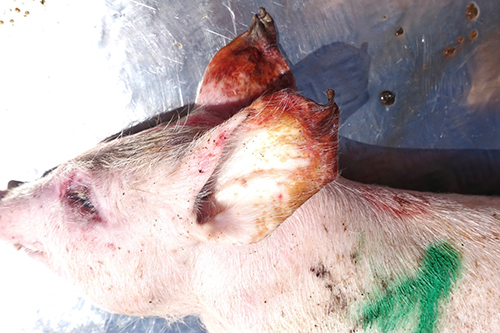
Фото 1. Поросенок 52 дней жизни. Сочетанный токсикоз, очаги некроза кожи

Фото 2. Поросенок 54 дней жизни. Сочетанный токсикоз, многочисленные эрозии на коже
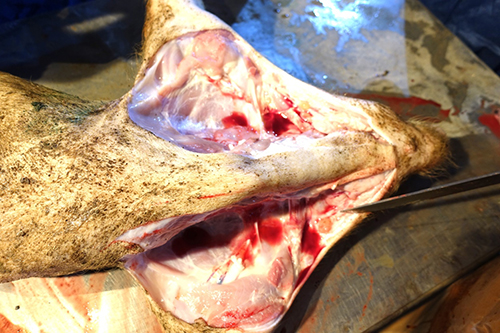
Фото 3. Поросенок 52 дней жизни. Сочетанный токсикоз, анемия, водянистая кровь
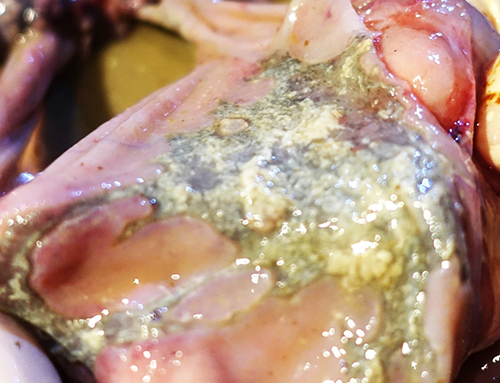
Фото 4. Поросенок 52 дней жизни. Сочетанный токсикоз, очаги некроза и эрозии на слизистой оболочке желудка

Фото 5. Поросенок 52 дней жизни. Сочетанный токсикоз, эрозии и кровоизлияния на слизистой оболочке желудка
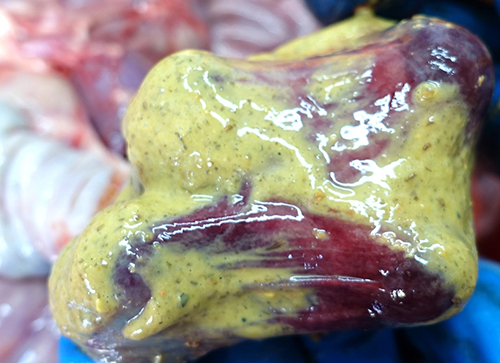
Фото 6. Поросенок 54 дней жизни. Сочетанный токсикоз, острый катаральный гастрит
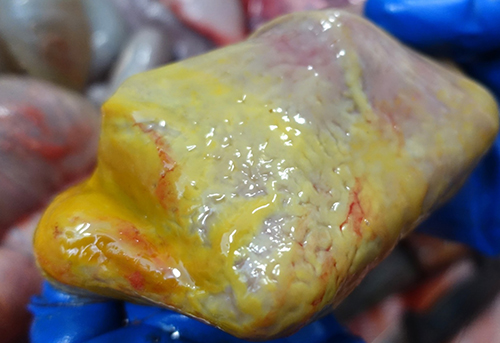
Фото 7. Поросенок 55 дней жизни. Сочетанный токсикоз, подострый катаральный гастрит
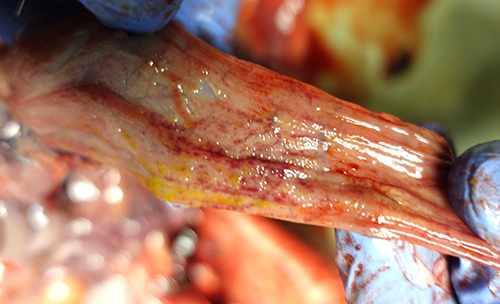
Фото 8. Поросенок 54 дней жизни. Сочетанный токсикоз, кровоизлияния на слизистой оболочке тонкой кишки
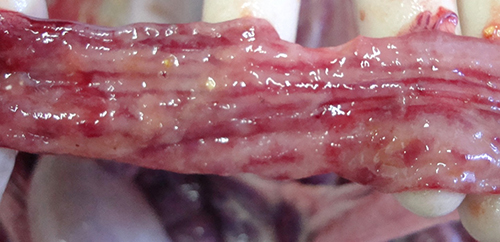
Фото 9. Поросенок 55 дней жизни. Сочетанный токсикоз, острый катаральный энтерит
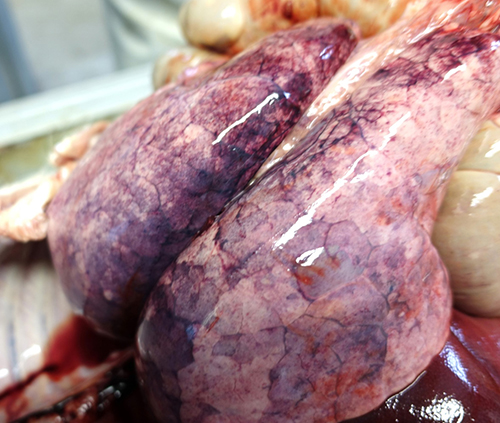
Фото 10. Поросенок 55 дней жизни. Сочетанный токсикоз, отек легких
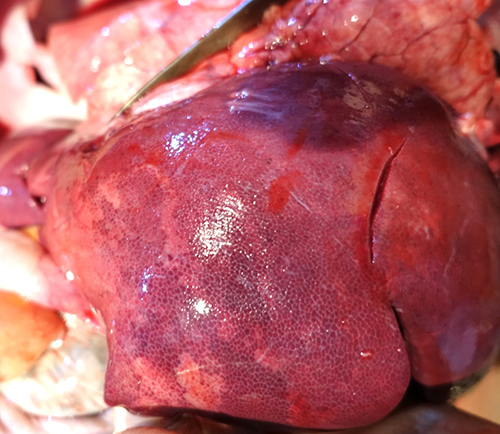
Фото 11. Поросенок 55 дней жизни. Сочетанный токсикоз, острый реактивный гепатит
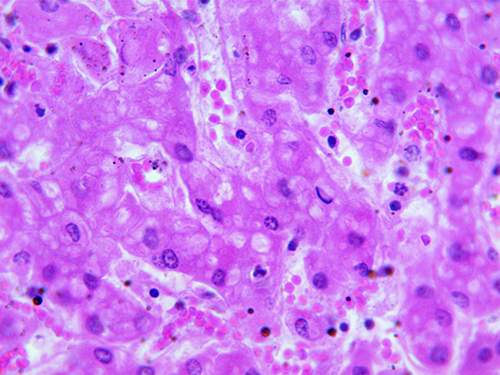
Фото 12. Поросенок 55 дней жизни. Сочетанный токсикоз, острый реактивный гепатит. Гистосрез печени. Ув. 600. Окраска гематоксилином и эозином
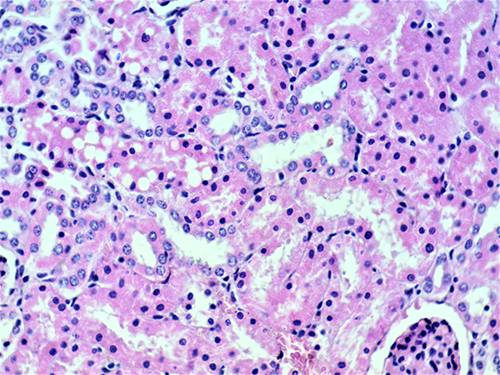
Фото 13. Поросенок 55 дней жизни. Сочетанный токсикоз, водяночная дистрофия и лизис клеток эпителия каналец. Гистосрез почки. Ув. 400. Окраска гематоксилином и эозином
Литература
- Ахметов Ф.Г. Профилактика микотоксикозов животных/Ф.Г. Ахметов//Труды второго съезда ветеринарных врачей Республики Татарстан. Казань, 2001. С. 235‒239.
- Безбородова Н.А. Мониторинг микотоксинов в кормах и кормовом сырье и клинико-иммунологические особенности микотоксикозов животных в Уральском регионе: Автореферат диссертации кандидата вет. наук/Безбородова Н.А. Екатеринбург, 2009. 155 с.
- ГОСТ 33867-2016. Требования при выращивании и откорме свиней на мясо для выработки продуктов детского питания. Типовой технологический процесс. Применяется с 01.01.2018. docs.cntd.ru›document/1200141722.
- Иванов А.В. Микотоксикозы (биологические и ветеринарные аспекты)/А.В. Иванов, В.И. Фисинин, М.Я. Тремасов, К.Х. Папуниди. М.: Колос, 2010. 392 с.
- Кононенко Г.П. Видовой состав и токсикологическая характеристика грибов рода Аspergillus, выделенных из грубых кормов/Г.П. Кононенко, Е.А. Пирязева, Е.В. Зотова, А.А. Буркин. Сельскохозяйственная биология, 2017. Т. 52. №6. С. 1279‒1286.
- Максимально допустимые уровни (МДУ) микотоксинов в кормах для сельскохозяйственных животных, утвержденные ГУВ Минсельхоза СССР от 01.02.1989. №434-17. https://forum.tks.ru/printthread.php?t=493792.
- Монастырский О.А. Микотоксины ‒ глобальная проблема безопасности продуктов питания и кормов/О.А. Монастырский. Агрохимия, 2016. №6. С. 67‒71.
- Папуниди К.Х. Микотоксины (в пищевой цепочке): Монография/М.Я. Тремасов, В.И. Фисинин. 2-е изд., доп. Казань: ФЦТРБ-ВНИВИ, 2017. 158 с.
- ТР ТС 0152011. Технический регламент Таможенного союза «О безопасности зерна» (с изменениями на 2020 год). https://docs.cntd.ru/document/902320395
- Adhikari M. T-2 mycotoxin: Toxicological effects and decontamination strategies/M. Adhikari, B. Negi, N. Kaushik, A. Adhikari. Oncotarget, 2017. Vol. 8(20) P. 33933‒33952. DOI: 10.18632/oncotarget.15422.
- Paula K. Co-occurrence of regulated, masked and emerging mycotoxins and secondary metabolites in finished feed and maize: An extensive survey/K. Paula, K. Gregor, N. Karin et al. Toxins, 2016. Vol. 8. P. 363.
- Pierron A. Impact of two mycotoxins deoxynivalenol and fumonisin on pig intestinal health/A. Pierron, I. Alassane-Kpembi, I.P. Oswald. Porc. Health, 2016. Vol. 2(21). https://doi.org/10.1186/s40813-016-0041-2.








