В 2025 году журналу
ИСПОЛНИТСЯ
95 ЛЕТ!
ЧИТАЙТЕ
Материалы к юбилею >>>

РУБРИКИ
 Племенное дело |
 Крупный план |
 Актуально |
 Корма |
 Техническая политика |
 Событие |
 Ветеринария |
 Эксклюзивное интервью |
 Статистика |
 Выставки |
Творчество
наших читателей
ЧИТАЙТЕ
Автор С.И. КАЛИНИЧЕНКО
ГИМН СВИНЬЕ >>>
СТАТЬИ ИЗ НОМЕРА
DOI:10.37925/0039-713X-2023-2-8-12
УДК 636.4.
МЕТОДИКА ОТБОРА ПРОБ ДНК СВИНЕЙ ДЛЯ ГЕНОТИПИРОВАНИЯ
Р.М. ЗАЙНУЛЛИН, гендиректор, А.И. Рудь, доктор с.-х. наук, зам. гендиректора по селекционно-генетической работе, А.С. Кокорев, гл. технолог, ООО «Башкирская мясная компания», Г.Г. Юрков, руководитель проекта, Н.С. Молдавская, аккаунт-менеджер, ООО «Ксивелью»
Проведено сравнение генотипирования и секвенирования ДНК. Проанализированы причины повышения эффекта селекции при комбинировании BLUP-оценки и генотипирования ДНК свиней. Описана методика отбора проб для генотипирования свиней в условиях ООО «Башкирская мясная компания»: взятие ушного выщипа и отбор волосяных фолликулов.
Ключевые слова: свиноводство, генотипирование ДНК, секвенирование ДНК, методика отбора проб для генотипирования ДНК свиней, селекция.
Pig DNA sampling methodology for genotyping
R.M. ZAINULLIN, general director, A.I. RUD, doctor of agricultural sciences, deputy general director for selection and genetic work, A.S. KOKOREV, chief technologist, Bashkirskaya Myasnaya Kompaniya LLC, G.G. YURKOV, project lead, N.S. MOLDAVSKAYA, account manager, Ksivelyu LLC
The paper discusses comparison between genotyping and sequencing and their use in pig-breeding. The reasons for the increase in response to selection when combining BLUP and genotyping are analyzed. A sampling technique for genotyping pigs under the conditions of the porcine farm Bashkirskaya Myasnaya Companiya LLC is described: taking a tissue sample and sampling hair follicles.
Key words: pig-breeding, genotyping, DNA sequencing, pig DNA sampling methodology, animal breeding and selection.
Введение
Существенное повышение эффекта селекции в последние десятилетия достигнуто за счет дополнения оценки генотипа по методу BLUP результатами анализа ДНК племенных животных. В ООО «Башкирская мясная компания» совместно с ООО «Ксивелью» стартовал процесс по созданию собственной независимой системы оценки генетического потенциала племенных свиней. Аналогичные задачи стоят перед многими племенными свинокомплексами. Делимся своим опытом с коллегами.
Методы анализа ДНК
Для анализа ДНК в большинстве случаев используется два метода ‒ секвенирование и генотипирование. Эти два метода имеют ряд существенных различий (табл.).
Таблица. Сравнение генотипирования и секвенирования ДНК
|
№ п/п |
Характеристика |
Генотипирование ДНК |
Секвенирование ДНК |
|
1 |
Оборудование |
Анализатор ДНК |
Секвенатор ДНК* |
|
2 |
Потенциал |
Генотипирование ‒ процесс определения с помощью маркеров, каким генетическим вариантом обладает исследуемое животное. Результат: оценка участка ДНК, использование чипов различной плотности** |
Секвенирование ‒ определение правильного порядка нуклеотидной последовательности в исследуемом фрагменте ДНК. Результат: соединение фрагментов в единую модель генома |
|
3 |
Варианты анализа |
Оценка животных по маркерам (мутациям ДНК), установление их связи с продуктивностью |
Расшифровка и оценка всего генома животного, 3 млрд SNP |
|
4 |
Результат |
3 варианта: мутация есть, мутации нет, гетерозиготный вариант |
Выявление множества мутаций на основании анализа всего генома данных и определение их связи с продуктивностью |
*Секвенатор может выполнять функцию анализатора ДНК, но имеет более широкие возможности.
**Чипы низкой плотности – до 10 тыс. SNP, средней плотности – до 100 тыс. SNP, высокой плотности – до 1 млн SNP.
Секвенирование существенно дороже генотипирования (3 млрд SNP по сравнению с максимум 1 млн SNP при генотипировании). Развитие технологии генотипирования в немалой степени обусловлено необходимостью удешевления данных исследований. В последние годы отмечено значительное снижение стоимости секвенирования ДНК с тенденцией к дальнейшему удешевлению. Динамика стоимости делает потенциально возможным использование секвенирования ДНК для анализа генома свиней в племенном свиноводстве в среднесрочной перспективе.
Анализаторы ДНК для генотипирования производятся в США. Основные игроки на рынке – две американские компании: Illumina ‒ около 80% рынка [1] и Thermo Fisher Scientific ‒ около 20% рынка [2].
Чипы, анализаторы ДНК и программы для обработки данных генотипирования не универсальны. Нельзя на анализаторах ДНК Illumina использовать чипы Thermo Fisher Scientific и наоборот. Производителей секвенаторов существенно больше. Широкое распространение получают китайские секвенаторы (DNBSEQ-G50, DNBSEQ-G400 и др.). В России налажено производство секвенаторов под торговой маркой «Нанофор» («Нанофор-05», компания «Синтол») [3].
По итогам генотипирования или секвенирования получают так называемые IDATA-файлы (файлы с данными). Для обработки результатов секвенирования используются специализированные компьютерные программы (Genome Studio компании Illumina, R-studio и др.). Специалистов, умеющих обрабатывать информацию в файлах, в России немного. Процесс обработки заключается в написании скриптов (программных запросов), на основании которых производятся внутренние расчеты. Для них необходимы данные фенотип ‒ генотип. Без фенотипа животного его геномный анализ в настоящее время не имеет смысла.
Стоимость лаборатории по генотипированию на китайских секвенаторах – 120‒150 млн рублей, на оборудовании Illumina – свыше 190 млн рублей. Поэтому было принято решение проводить исследования в специализированной лаборатории вне компании.
Влияние генотипирования на эффективность селекции
В настоящее время основной эффект в селекции обусловлен применением метода BLUP. Тем не менее, комбинирование BLUP-оценки с результатами генотипирования позволяет повысить точность оценки генетического потенциала свиней, и как следствие, эффект селекции, в среднем на 10‒40% в зависимости от селекционного признака. Нами выделены три основные причины повышения точности оценки генотипа свиней при уточнении ее результатами генотипирования.
1. Использование при оценке генотипа свиней маркеров продуктивности (рис. 1).
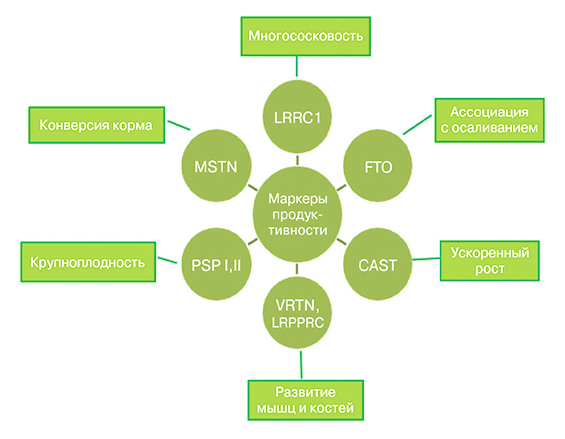
Рис. 1. Маркеры продуктивности и связанные с ними селекционные признаки
Метод предусматривает выявление мутаций (полиморфизм генов), связей между мутацией и показателями продуктивности животных. Маркеры установлены по большинству селекционных признаков [4]. Первый маркер (ген эстрогенового рецептора, ESR) был открыт свыше 20 лет назад. Генотипированию была подвергнута 161 свиноматка из 50 различных семейств [5]. Нами собрана информация о 35 маркерах, отвечающих за различные производственные параметры свиней.
Возможна разработка систем генотипирования в лабораториях с гарантированным определением в генетическом материале конкретных маркеров при уже известной локализации этих маркеров в геноме.
2. Уточнение влияния генотипов родителей на генотип потомка (уточнение величины h).
По умолчанию половину генов потомок получает от отца, половину ‒ от матери. Значит, наследуемость (h, или коэффициент путей Райта) принята в моделях при BLUP-оценке как 0,5. На основании анализа генотипов потомка и его родителей можно более точно определить соотношение генов, переданных потомку от отца и матери, скорректировав величину h (рис. 2). Поэтому при BLUP-оценке влияние фенотипов отца и матери на фенотип потомка будет неравнозначно и смещено в одну или другую сторону.
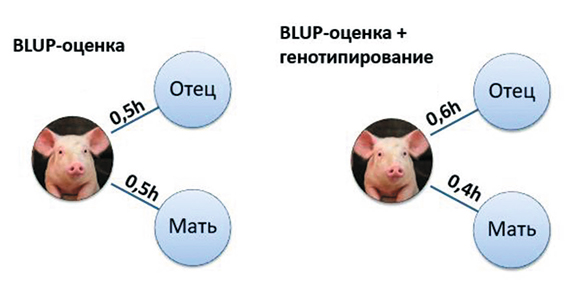
Рис. 2. Влияние генотипов родителей на генотип потомка при BLUP-оценке и комбинированной оценке BLUP + генотипирование
3. Формирование референтной базы данных генотипов.
Важнейшей целью генотипирования является разработка референтной базы. База должна включать информацию о генотипе не менее 3‒5 тыс. голов по каждой породе (генетике) свиней. В ООО «Башкирская мясная компания» запланировано создание трех референтных баз по породам йоркшир, ландрас и дюрок датской генетики. В базу должны входить животные, имеющие показатели продуктивности в интервале от минимального до максимального значения. Генотипы животных, у которых селекционные признаки достигли целевых показателей, используются в качестве эталонных. С ними производится сравнение вновь генотипируемых свиней. Предпочтение для чистопородного разведения отдается животным, у которых высокие значения EBV (estimated breeding value – прогнозируемая племенная ценность по селекционным признакам) сочетаются с максимальной схожестью собственного генотипа с эталонными.
Отбор проб для генотипирования
В качестве биопроб для генотипирования могут выступать ушные выщипы или волосяные фолликулы. Возможно применение для анализа фрагмента хвоста при его обрезке у поросенка в трех-пятидневном возрасте. В этом случае необходимо предусмотреть систему хранения образцов в течение длительного времени. Генотипирование отобранных образцов проводится в более старшем возрасте животных. Цель – получение пар данных фенотип (после бонитировки) – генотип перед принятием решения о дальнейшем использовании животного.
В ООО «Башкирская мясная компания» отработаны два варианта отбора проб ‒ ушные выщипы и волосяные фолликулы. Для отбора ушных выщипов использовался аппликатор (пистолет) Allflex (фото 1) и специализированные пробирки для хранения проб (фото 2).

Фото 1. Аппликатор Allflex для отбора проб
Примечание: для отбора проб использовали две модели ‒ 1а и 1б. Модель 1б более удобна и долговечна ‒ она отличается пластиковым мини-контейнером для фиксации пробирок. Механизм отбора проб в обеих моделях одинаковый.

Фото 2. Пробирки для отбора проб
Механизм отбора проб:
1) работа по отбору проб проводится обязательно в перчатках, чтобы исключить контакт кожи человека с образцами (смешивание ДНК);
2) нажать на черный зажим, зафиксировать в пистолете пробирку (фото 3);
3) поставить пробирку в аппликатор (пистолет), рычаги на красном фиксаторе должны быть вверху (фото 4);
4) легким нажатием курка зафиксировать пробирку в пистолете;
5) перевести пробирку в рабочее состояние. Для этого убрать красный фиксатор пробирки, наклоняя его вперед (фото 5);
6) отобрать пробы для генотипирования (фото 6). Выбирайте место взятия образца ближе к центру уха животного, на участке без кровеносных сосудов;
7) удалить поршень (иглу) пробирки из пистолета отжатием черного рычага пистолета вперед от себя (фото 7).

Фото 3. Установка пробирки в аппликаторе а ‒ зажим на передней части аппликатора (разжат), б ‒ положение пробирки в аппликаторе

Фото 4. Заправка пробирки в аппликатор (пистолет)

Фото 5. Перевод пробирки в рабочее состояние, удаление фиксатора

Фото 6. Отбор пробы для исследования

Фото 7. Удаление поршня пробирки из пистолета
После отбора пробы в пробирке происходит вспенивание жидкости. В условиях производственного сектора бывает сложно определить, попал ли ушной выщип в пробирку. Критерием правильности отбора пробы является отсутствие красного шарика на игле (поршне) пробирки (фото 8а). Этот шарик должен закупоривать пробирку с пробой ДНК (фото 8б).

Фото 8. Критерий отбора пробы ДНК А ‒ пистолет без красного шарика на поршне (см. стрелку), б ‒ пробирка с ушным выщипом
Коэффициент расхода пробирок по нашему опыту – 84% (отобрана 101 проба из 120 пробирок в случае применения первой модели (фото 1а). В дальнейшем при использовании модели, представленной на фото 1б, потери пробирок меньше. Оптимальный запас – не менее 20% пробирок от планового количества проб для отбора.
Причины выхода пробирок из строя:
1) разъединение пробирки на два фрагмента при некорректном извлечении из коробки. В дальнейшем можно зафиксировать обе части пробирки в пистолете;
2) ушной выщип не попадает в пробирку после отбора (при высокой толщине уха у старых свиноматок).
В качестве альтернативы отработана методика отбора волосяных фолликулов у хряков. Для корректного генотипирования в пробе должно быть не менее 30 живых волосяных фолликулов.
Практика показала, что такое количество фолликулов возможно отобрать в среднем после пяти-шести выщипов. Этот метод более обоснован при отборе проб у хряков, так как более безопасен, хотя и более трудоемок.
Для отбора волосяных луковиц использовали конверты Neogen (фото )Выщипы делали обычными строительными пассатижами с загнутыми концами (фото 10). После выщипа щетины волосяные луковицы приклеивали к липкой части полоски внутри конверта (фото 11). Далее конверт закрывали, выступающую за границы конверта щетину обрезали ножницами, подписывали номер хряка (свиноматки) на конверте (фото 12) (не все лаборатории готовы использовать в качестве проб ДНК волосяные луковицы).

Фото 9. Конверт Neogen для отбора волосяных луковиц

Фото 10. Отбор волосяных фолликулов у хряков

Фото 11. Размещение волосяных фолликулов в конверт на липкую ленту

Фото 12. Проба волосяных луковиц, готовая к транспортировке
Выводы
1. Производство отечественных секвенаторов сопровождается удешевлением стоимости секвенирования (полногеномного анализа), что делает возможным использование данного метода в племенном свиноводстве в среднесрочной перспективе.
2. Повышение эффекта селекции при комбинировании BLUP-оценки с результатами генотипирования достигается за счет трех факторов:
‒ использования в оценке маркеров продуктивности (мутаций генов, связанных с производственными показателями);
‒ уточнения величины коэффициента путей (по Райту), характеризующих соотношение влияния генотипов отца и матери на генотип (фенотип) потомка;
‒ формирования референтной базы по определенной породе или генетике свиней с парами фенотип ‒ генотип по каждому животному. В зависимости от желательного фенотипа выделение эталонных генотипов, с которыми сравнивают вновь генотипированных животных.
3. В качестве образцов для генотипирования ДНК перспективно использование ушных выщипов. У агрессивных хряков – пробы волосяных фолликулов (не менее 30 штук) по описанной выше методике.
Литература
- Sequencing and array-based solutions for genetic research.
- Официальный сайт АО «Термо Фишер Сайентифик» (Россия). thermoscientific-lab.ru.
- Я. Алексеев. Первый российский секвенатор ДНК/Алексеев Я. PCR News, 2021.
- Радюк А.В. Взаимосвязь генетических маркеров с продуктивностью свиней: Автореферат диссертации кандидата с.-х. наук. Персиановский, 2020. 120 с.
- Зиновьева Н.А. Молекулярно-генетические методы и их использование в свиноводстве. Достижения науки и техники АПК, 2008. №10. С. 34‒36.
- M. Rotschild, C. Jacobson, D. Vaske et al. The estrogen receptor locus is associated with a major gene influencing litter size in pigs. Proc. Natl. Acad. Sci. USA: Genetics, 1996. Vol. 93. P. 201‒205.








