В 2025 году журналу
ИСПОЛНИТСЯ
95 ЛЕТ!
ЧИТАЙТЕ
Материалы к юбилею >>>

РУБРИКИ
 Племенное дело |
 Крупный план |
 Актуально |
 Корма |
 Техническая политика |
 Событие |
 Ветеринария |
 Эксклюзивное интервью |
 Статистика |
 Выставки |
Творчество
наших читателей
ЧИТАЙТЕ
Автор С.И. КАЛИНИЧЕНКО
ГИМН СВИНЬЕ >>>
СТАТЬИ ИЗ НОМЕРА
DOI:10.37925/0039-713X-2023-2-27-31
УДК 636.47
ЛИПИДОМ РАСТУЩИХ И ЗАВЕРШИВШИХ ФАЗУ РОСТА ООЦИТОВ СВИНЕЙ
Д.А. СТАРИКОВА, кандидат биолог. наук, научный сотрудник, е-mail: live8avis@mail.ru, Т.И. КУЗЬМИНА, доктор биолог. наук, профессор, е-mail: prof.kouzmina@mail.ru, лаборатория биологии развития, Всероссийский научно-исследовательский институт генетики и разведения сельскохозяйственных животных – филиал ФГБНУ «Федеральный исследовательский центр животноводства ‒ ВИЖ имени академика Л.К. Эрнста» (Санкт-Петербург, г. Пушкин)
Анализируются особенности функционирования липидома (морфология и локализация липидных капель, интенсивность флуоресценции комплекса Nile red/липидная капля) в донорских ооцитах свиней (Sus scrofa domesticus) в зависимости от их функционального статуса и диаметра фолликулов. Обосновывается необходимость коррекции протоколов экстракорпорального созревания ооцитов, не завершивших фазу роста in vivo.
Ключевые слова: ооциты свиньи, ВСВ-тест, Nile red, липидные капли, фолликулы.
Lipidome of growing and have finished growth phase porcine oocytes
D.A. STARIKOVA, PhD, researcher, е-mail: live8avis@mail.ru, T.I. KUZMINA, doctor of biological sciences, professor, e-mail: prof.kouzmina@mail.ru, developmental biology laboratory, Russian Research Institute of Farm Animal Genetics and Breeding ‒ Branch of the L.K. Ernst Federal Science Center for Animal Husbandry (St. Petersburg, Pushkin)
Peculiarities of lipidome functioning (morphology and localization of lipid droplets, fluorescence intensity of the Nile red/lipid drop complex) in donor porcine (Sus scrofa domesticus) oocytes are analyzed depending on their functional status and follicle diameter. The necessity of adjusting the protocols for extracorporeal maturation of oocytes that have not finished the growth phase in vivo is substantiated.
Key words: porcine oocytes, BCB-test, Nile red, lipid drioplets, follicules.
Введение
В последние годы в связи с активизацией исследований в области клеточной и генетической инженерии значительно возросла необходимость в наличии большого количества донорских ооцитов свиней с высокими качественными характеристиками. Популяция донорских ооцитов, выделяемых из постмортальных яичников животных, гетерогенна по компетентности к дальнейшему созреванию и оплодотворению. К тому же часть гамет находится в фазе роста и не в состоянии сразу после их извлечения из фолликулов приступить к этапу завершения ядерно-цитоплазматического созревания in vitro.
Одним из способов ранжирования ооцитов по завершенности фазы роста и компетентности для дальнейшего созревания и оплодотворения ооцитов является ВСВ-диагностика, основанная на обработке женских гамет витальным красителем бриллиантовым кристаллическим голубым (BCB), являющимся индикатором активности глюкозо-6-фосфатдегидрогеназы [1]. Формирование яйцеклетки in vitro зависит от адекватности процессов ядерно-цитоплазматического созревания условиям in vivo.
В процесс созревания ооцитов вовлечены клеточные органеллы, в том числе липидные капли (ЛК), выполняющие в клетке функцию энергетических депо, а также транспортных средств для поддержания внутриклеточного метаболизма в периоды низкой доступности энергии [2]. Липидные капли могут прикрепляться к различным органеллам, включая ядро, митохондрии, лизосомы и другие, и объединять их, вовлекая в этапы липидного метаболизма [3, 4]. Кроме того, липидные капли участвуют в обмене и утилизации липидов, распределении клеточных белков [5]. Однако, как показано на ооцитах коров, повышенное содержание липидных капель препятствует успешному созреванию, оплодотворению и в дальнейшем ‒ развитию эмбрионов [6].
Женские гаметы вида Sus scrofa domesticus (свинья домашняя) обладают высоким содержанием липидов, из которых на триглицериды приходится около 74 нг в отличие от гамет коров (25 нг). Донорские ооциты свиней – перспективная модель для изучения особенностей липидного метаболизма при формировании яйцеклетки в условиях экстракорпорального культивирования [7].
В связи с вышеизложенным мониторинг показателей функциональной активности липидома в ооцитах свиней in vitro – актуальная задача, направленная на выявление механизмов формирования яйцеклетки животных, разработку эффективных биомаркеров их качества и совершенствование этапов клеточных репродуктивных технологий.
Цель исследования – оценить показатели морфофункциональной активности липидных капель (морфология, локализация и интенсивность флуоресценции комплекса Nile red/липидная капля) донорских ооцитов свиней в зависимости от их функционального статуса и диаметра фолликула.
Материалы и методы исследований
В экспериментах использовали ооцит-кумулюсные комплексы (ОКК), полученные постмортально из яичников шести-восьмимесячных свинок породы ландрас на мясоперерабатывающем комбинате «Тосненский» (Ленинградская обл.). ОКК извлекали аспирацией из антральных фолликулов диаметром <3 мм, от 3 мм до 5 мм и более 5 мм с высоким тургором и обширной васкуляризацией.
Отбирали ооциты, окруженные не менее чем пятью-шестью слоями плотного компактного кумулюса, с гомогенной тонкозернистой цитоплазмой и равномерной по ширине зоной пеллюцида, после чего гаметы переносили в среду ТС-199 с 50 мкг/мл гентамицина. Далее для проведения ВСВ-диагностики ОКК помещали в 13 µМ рабочего раствора ВСВ на 60 минут. ОКК отмывали в среде ТС-199 с 50 мкг/мл гентамицина и ранжировали на группы: ооциты с окрашенной цитоплазмой (завершившие фазу роста или ВСВ(+) и неокрашенные ооциты (растущие или ВСВ(-).
Перед оценкой интрацеллюлярных липидных капель ооциты денудировали с помощью препаровальной иглы и далее поместили в раствор Nile red (концентрация 1 µМ) в темноту на пять минут при 24oC. Окрашенные ооциты разместили на предметных стеклах в минимальных количествах среды ТС-199, вокруг поставили три капли раствора DABCO с глицерином в соотношении 1:3. Затем ооциты осторожно накрыли покровными стеклами и заклеили лаком.
Образцы анализировали с помощью микроскопа Carl Zeiss Axio Imager.A2m (длины волн ‒ Ex/Em = 552/636 nm). Оценку морфологии, локализации и интенсивности флуоресценции липидных капель (ИФЛК) проводили путем фиксации изображения ооцитов микрофотосъемкой посредством программного обеспечения ВидеоТест FISH 2.0 (Россия). Используя программу JMicroVision 1.2.7, определяли морфофункциональные показатели ЛК.
Липидные капли, имеющие диаметр менее 10% от диаметра ооцита, определяли как гранулы, а липидные капли, имеющие диаметр более 10% от диаметра ооцита, ‒ как кластеры [8]. Оценку локализации ЛК проводили согласно методике, описанной Ariu F. et al. (2016): периферийно-перинуклеарная, диффузная (равномерное расположение липидных капель в цитоплазме ооцита), хаотичная (неравномерное расположение липидных капель в ооплазме) [9]. ИФЛК оценивали, используя цветовую модель RGB. Количество пикселей, попадающих в определенную группу по интенсивности свечения и превышающее половину площади ооцита, являлось основанием для выделения клетки в определенную группу:
‒ первая ‒ с низкой интенсивностью флуоресценции (ИФ) «+» (0‒80);
‒ вторая – со средней ИФ «++» (80‒160);
‒ третья – с высокой ИФ «+++» (160‒255) [10].
Для сравнения результатов экспериментов использовали критерий Фишера. Достоверность различия сравниваемых средних значений оценивали с помощью программы Statistica 6.0 при двух уровнях значимости ‒ P<0,01, P<0,05 для трех независимых экспериментов.
Результаты исследований
В исследовании проведена оценка показателей морфофункциональной активности липидома в донорских ооцитах свиней, выделенных из 345 антральных фолликулов постмортальных яичников на стадии фолликулярного роста. На рисунке 1 представлены результаты анализа морфологии липидных капель в ВСВ-тестированных ооцитах свиней из фолликулов разного диаметра. Во всех исследуемых группах доли ооцитов с ЛК в виде гранул (от 13% до 81%) были достоверно выше (P<0,01) уровней гамет со смешанными ЛК (от 1% до 6%). Отмечено, что уровень ВСВ(+)-ооцитов с гранулярными липидными каплями повышался по мере роста диаметра фолликулов (с 69% до 81%).
Выявлено, что доля ВСВ(+)-гамет с гранулярными ЛК из фолликулов диаметром 5‒8 мм превышает таковую из фолликулов диаметром <3 мм (81% против 69%) (Р<0,05). Доля ВСВ(-)-гамет с гранулированными липидными каплями из фолликулов диаметром <3 мм (28%) больше уровня аналогичных групп ооцитов из фолликулов диаметром 3‒5 мм (13%) и 5‒8 мм (13%) (P<0,01). В экспериментах установлено достоверное превышение доли ВСВ(+)-ооцитов со смешанными ЛК, полученными из фолликулов диаметром 3‒5 мм, над уровнем аналогичной группы гамет, выделенной из фолликулов диаметром <3 мм (6% против 1%) (P<0,01). Следует отметить тенденцию к увеличению доли растущих гамет со смешанным липидомом с 2% до 4% в зависимости от роста диаметра фолликула.
Активность внутриклеточных процессов зависит от мобильного взаимодействия органелл, их коммуникации и транспортировки при участии липидных капель гранулированной формы [11]. Наши данные показывают увеличение доли ооцитов с гранулированным липидомом по мере роста диаметра фолликула, что может быть свидетельством активности интрацеллюлярных процессов при завершении мейотического созревания женской гаметы.
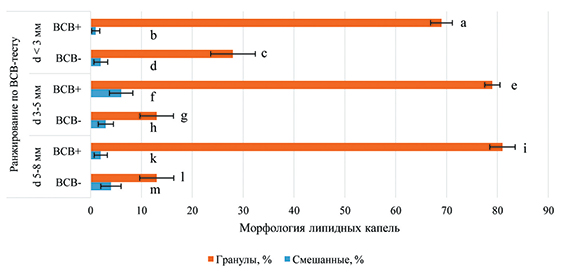
Рис. 1. Морфология липидных капель в ВСВ-тестированных ооцитах свиней из фолликулов разного диаметра (345 ооцитов, три повторности)
Примечание: достоверные различия по критерию Фишера: a:i, f:k ‒ P<0,05, a:b, b:f, c:g, c:l, c:d, e:f, g:h, i:k, l:m, ‒ P<0,01.
Анализ локализации липидных капель выявил прямую зависимость увеличения доли ВСВ(+)-ооцитов с диффузной локализацией ЛК от роста диаметра фолликула: с 26% (диаметр фолликула <3 мм) до 38% (диаметр фолликула 3‒5 мм) (P<0,05) и 45% (диаметр фолликула 5‒8 мм) (P<0,01). Доля выделенных из фолликулов диаметром <3 мм ВСВ(-)-ооцитов с диффузной локализацией ЛК была достоверно выше уровня гамет из фолликулов диаметром 3‒5 мм (33% против 20%) (P<0,05) (рис. 2).
Отмечена тенденция к снижению доли растущих гамет с хаотичной локализацией липидных капель в зависимости от увеличения диаметра фолликула с 15% до 10% и 6%. Однако уровень ВСВ(-)-гамет с хаотичной локализацией из фолликулов диаметром <3 мм оказался выше такового в группе ооцитов, полученных из фолликулов диаметром 6‒8 мм (15% против 6%) (P<0,05).
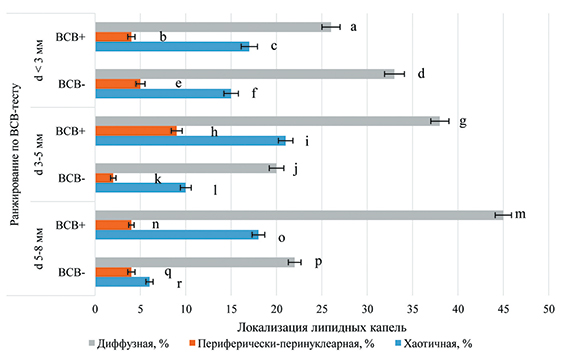
Рис. 2. Локализация липидных капель в ВСВ-тестированных ооцитах свиней из фолликулов разного диаметра (235 ооцитов, три повторности)
Примечание: достоверные различия по критерию Фишера: a:g, d:j, f:r, h:i, h:k, i:l, j:l, k:l, o:r ‒ P<0,05, a:m, a:b, b:c, g:h, g:i, g:j, m:n, m:o, m:p, n:o, d:e, d:f, e:f, j:k, p:q, p:r ‒ P<0,01.
Во всех исследуемых группах ооцитов доля ооцитов с диффузным распределением липидных капель (от 20% до 45%) была больше уровня ооцитов с липидными каплями периферически-перинуклеарной локализации (от 2% до 9%) (P<0,01). Доли растущих ооцитов с диффузной локализацией ЛК из всех диаметров фолликулов достоверно превышали уровни ооцитов с липидными каплями хаотичной локализации. Аналогично доля ВСВ(+)-гамет с диффузной локализацией ЛК была выше уровня ооцитов с хаотичной локализацией ЛК из всех диаметров фолликулов.
Доказано, что доли гамет с хаотичной локализацией ЛК достоверно превышают уровни ооцитов с периферически-перинуклеарной локализацией вне зависимости от завершенности фазы роста, за исключением долей ВСВ(-)-ооцитов, полученных из фолликулов диаметром 5‒8 мм.
Созревание фолликула тесно связано с ростом и созреванием ооцита как цитоплазматическим, так и ядерным. В самых крупных фолликулах диаметром 5‒8 мм вероятность нахождения растущего ооцита меньше, чем завершившего стадию роста, что подтверждается нашими данными, показывающими более низкий уровень ВСВ(-)-ооцитов в них по сравнению с ВСВ(+), как это сформулировано ранее [12]. При этом наблюдается высокая доля ВСВ(-)-гамет с диффузной локализацией и низкая – с хаотичной, что может свидетельствовать о завершении фазы роста и реинициации мейотического созревания.
В нашем исследовании отмечено превышение уровня ВСВ(+)-ооцитов с диффузной локализацией ЛК над долей ВСВ(-)-ооцитов из фолликулов диаметром 3‒5 мм (38% против 20%) и 5‒8 мм (45% против 22%), а также доли ВСВ(+)-ооцитов с хаотичной локализацией ЛК над уровнем ВСВ(-)-ооцитов из фолликулов диаметром 3‒5 мм (21% против 10%) и 5‒8 мм (18% против 6%) (P<0,01). Доля ВСВ(+)-гамет с периферически-перинуклеарной локализацией ЛК (диаметр фолликулов 3‒5 мм) превосходила аналогичный показатель в группе ВСВ(-)-ооцитов (9% против 2%) (P<0,05).
Взаимодействие интрацитоплазматических компартментов гаметы и липидных капель оказывает влияние на локализацию последних в цитоплазме [6]. К примеру, при созревании ооцитов in vitro происходит взаимосвязь липидных капель с митохондриями и микротрубочками, которая обуславливает периферическое распределение ЛК в клетке [13]. Кроме митохондрий и микротрубочек липидные капли также коммуницируют с эндоплазматическим ретикулумом, пероксисомами, лизосомами, комплексом Гольджи, что оказывает существенное воздействие на локализацию органелл, в том числе липидных капель [14‒16].
Наши результаты демонстрируют разницу между растущими и завершившими фазу роста гаметами по типу локализации, что предполагает активацию интрацитоплазматических процессов, сопровождающихся перемещением внутриклеточных компартментов в завершивших фазу роста ооцитах в зависимости от увеличения диаметра фолликула. При этом с ростом фолликулов, возможно, снижаются деструктивные изменения в растущих ооцитах, о чем свидетельствует сокращение доли гамет с хаотичной локализацией липидных капель.
Результаты анализа интенсивности флуоресценции комплекса Nile red/липидная капля в ВСВ-тестированных ооцитах свиней из фолликулов разного диаметра представлены на рисунке 3.
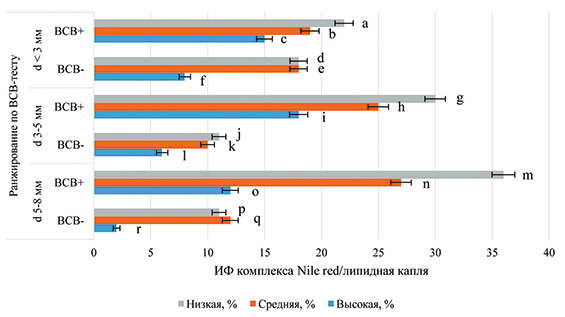
Рис. 3. Интенсивность флуоресценции комплекса Nile red/липидная капля в ВСВ-тестированных ооцитах свиней из фолликулов разного диаметра (292 ооцита, три повторности)
Примечание: достоверные различия по критерию Фишера: a:m, c:f, f:r, d:f, e:f, g:i, ‒ P<0,05, g:j, h:k, i:l, m:o, n:o, m:p,n:q, o:r, p:r, q:r ‒ P<0,01.
Уровень ВСВ(+)-ооцитов с низкой интенсивностью флуоресценции комплекса Nile red/липидная капля (ИФЛК), полученных из фолликулов диаметром <3 мм, достоверно меньше доли аналогичной группы гамет из фолликулов диаметром 5‒8 мм (22% против 36%) (P<0,05).
Отмечено, что вне зависимости от диаметра фолликула доли завершивших фазу роста гамет с высокой ИФЛК больше уровней растущих ооцитов. Доли ВСВ(+)-гамет со средней и низкой ИФЛК достоверно превышают доли ВСВ(-)-ооцитов с аналогичной ИФЛК, извлеченных из фолликулов диаметром 3‒5 мм или 5‒8 мм. Уровень ВСВ(-)-гамет с высокой ИФЛК из фолликулов диаметром <3 мм больше уровня ооцитов, полученных из фолликулов 5‒8 мм (8% против 2%) (P<0,05).
В популяции завершивших фазу роста ооцитов уровень гамет из фолликулов диаметром 5‒8 мм с высокой ИФ (12%) меньше долей с низкой (36%) и средней (27%) ИФЛК (P<0,01). Напротив, уровень ВСВ(+)-гамет из фолликулов диаметром 3‒5 мм с низкой ИФ больше доли гамет с высокой ИФ (30% против 18%) (P<0,05).
Одним из маркеров активности цитоплазматических процессов в клетке и липидного метаболизма является содержание триглицеридов в липидных каплях. В связи с тем, что краситель Nile red селективный к триглицеридам и связывается с ними, интенсивность флуоресценции окрашенных красителем Nile red липидных капель может априори выступать показателем содержания триглицеридов в них [17]. Процесс созревания ооцитов нуждается в имеющих энергетическую ценность жирных кислотах, которые образуются при гидролизе триглицеридов под действием липаз [18]. Последнее предполагает, что при динамических интрацитоплазматических взаимодействиях органелл в процессе созревания женской гаметы происходит истощение запасов триглицеридов и уровень ИФ комплекса Nile red/ЛК будет снижаться.
В общем, показатели флуоресценции уменьшаются и определяются как низкие («+»), что соответствует пиксельной градации от 0 до 80. Представленные данные в целом отражают тенденцию к сокращению доли гамет с низкой ИФ в завершивших фазу роста ооцитах, что согласуется с описанными выше предположениями.
В экспериментах выявлено повышение уровня растущих гамет с низкой ИФ в зависимости от увеличения диаметра фолликула. Это можно объяснить тем, что в гаметах, не успевших завершить фазу роста (ВСВ(-)-ооциты), выделенных из более крупных фолликулов (диаметр 3‒5 мм и 5‒8 мм), активируются процессы дегенерации, что, вероятно, приводит к накоплению триглицеридов в ЛК.
Заключение
В исследовании проведен мониторинг показателей морфофункциональной активности липидома ооцитов Sus scrofa domesticus, извлеченных из антральных овариальных фолликулов. Полученные данные свидетельствуют о зависимости морфофункциональных параметров липидома, а именно морфологии, локализации и интенсивности флуоресценции комплекса Nile red/липидная капля, от функционального статуса донорского ооцита (растущие или завершившие фазу роста) и диаметра фолликула, из которых они были выделены. В целом выявленные различия свидетельствуют об особенностях функционирования ЛК в растущих или завершивших фазу роста. Затухание липидного метаболизма в тестированных на момент аспирации из фолликулов ооцитов как завершивших фазу роста и повышение показателей функциональной активности ЛК в растущих гаметах вызывает необходимость модернизации протоколов экстракорпорального культивирования донорских ооцитов свиней с учетом функционального статуса гаметы.
Работа выполнена в рамках проекта №22-16-00084, поддержанного Российским фондом фундаментальных исследований
Литература
- Walker B.N., Nix J., Wilson C., Marrella M.A., Speckhart S.L., Wooldridge L., Yen C.N., Bodmer J.S., Kirkpatrick L.T., Moorey S.E., Gerrard D.E., Ealy A.D., Biase F.H. Tight gene co-expression in BCB positive cattle oocytes and their surrounding cumulus cells. Reproductive Biology and Endocrinology, 2022. 20(1). P. 119. https://doi.org/10.1186/s12958-022-00994-3.
- Geltinger F., Schartel L., Wiederstein M., Tevini J., Aigner E., Felder T.K., Rinnerthaler M. Friend or Foe: Lipid droplets as organelles for protein and lipid storage in cellular stress response, aging and disease. Switzerland, Basel: Molecules, 2020. Vol. 25(21). P. 5053. https://doi.org/10.3390/molecules25215053.
- Gao Q., Goodman J.M. The lipid droplet-a well-connected organelle. Frontiers in Cell and Developmental Biology, 2015. Vol. 3. P. 49. https://doi.org/10.3389/fcell.2015.00049.
- Schuldiner M., Bohnert M. A different kind of love ‒ lipid droplet contact sites. Biochim. Biophys. Acta ‒ Mol. Cell Biol. Lipids, 2017. 1862(10 Pt B):1188‒1196. DOI: 10.1016/j.bbalip.2017.06.005.
- Bischof J., Salzmann M., Streubel M.K., Hasek J., Geltinger F., Duschl J., Bresgen N., Briza P., Haskova D., Lejskova R., Sopjani M., Richter K., Rinnerthaler M. Clearing the outer mitochondrial membrane from harmful proteins via lipid droplets. Cell Death Discovery, 2017. Vol. 3. P.17016. https://doi.org/10.1038/cddiscovery.2017.16.
- Dunning K.R., Russell D.L., Robker R.L. Lipids and oocyte developmental competence: The role of fatty acids and b-oxidation. Reproduction, 2014. Vol. 148. P. R15–R27.
- McEvoy T.G., Coull G.D., Broadbent P.J., Hutchinson J.S., Speake B.K. Fatty acid composition of lipids in immature cattle, pig and sheep oocytes with intact zona pellucida. Journal of Reproduction and Fertility, 2000. Vol. 118(1). P. 163–170.
- Новичкова Д.А., Кузьмина Т.И., Усенбеков Е.С., Шахтамиров И.Я., Мутиева Х.М. Липидный анализ ооцитов Sus scrofa domesticus в зависимости от их функционального состояния. Астана: Вестник науки Казахского агротехнического университета имени С. Сейфуллина, 2017. №2(93). С. 69‒75.
- Ariu, F., Strina A., Murrone O., Falchi L., Bebbere D., Ledda S., Zedda M.T., Pau S., Bogliolo L. Lipid droplet distribution of immature canine ocytes in relation to their sizeand the reproductive stage. Animal Science Journal, 2016. М. 87. P. 147–150.
- Новичкова Д.А., Кузьмина Т.И., Ковтун С.И., Галаган Н.П. Характеристика популяции донорских ооцитов свиней на основе визуализации липидов флуоресцентным красителем Nile red//Материалы XVIII Международной научно-практической конференции «Актуальные проблемы интенсивного развития животноводства», посвященной 85-летию образования зооинженерного факультета. Горки, 2015. С. 333‒337.
- Barbosa A.D., Siniossoglou S. Function of lipid droplet organelle interactions in lipid homeostasis. Biochimica et Biophysica Acta, 2017. Vol. 1864. №9. P. 1459‒1468.
- Кузьмина Т.И., Мурза Г.В., Маташина О.П., Новичкова Н.О. Селекция донорских ооцитов свиней на основе ВСВ-теста//Актуальные проблемы сельскохозяйственной биотехнологии: сборник научных трудов. Пинск: ПолесГУ, 2012. С. 86‒89.
- Walther T.C., Farese R.V.Jr. Lipid droplets and cellular lipid metabolism. Annual Review of Biochemistry, 2012. Vol. 81. P. 687‒714.
- Dadarwal D., Honparkhe M., Dias F.C., Alce T., Lessard C., Singh J. Effect of superstimulation protocols on nuclear maturation and distribution of lipid droplets in bovine oocytes. Reproduction, Fertility and Development, 2015. Vol. 27. №8. P. 1137‒1146.
- Cohen S. Lipid droplets as organelles. International Review of Cell and Molecular Biology, 2018. Vol. 337. P. 83–110. DOI: 10.1016/bs.ircmb.2017.12.007.
- Renne M.F., Hariri H. Lipid droplet organelle contact sites as hubs for fatty acid metabolism, trafficking, and metabolic channeling. Frontiers in Cell and Developmental Biology, 2021. Vol. 9. №726261. DOI:10.3389/fcell.2021.726261.
- Greenspan Ph., Mayer E.P., Fowler St.D. Nile red: A selective fluorescent stain for intracellular lipid droplets. The Journal of Gill Biology, 1985. Vol. 100. P. 965‒973.
- Ibayashi M., Aizawa R., Mitsui J., Tsukamoto S. Homeostatic regulation of lipid droplet content in mammalian oocytes and embryos. Reproduction, 2021. Vol. 162. № P. R99‒R109.







